來源:中考網整合 2010-10-06 10:20:06
中考化學復習教案:氧氣要點精講
2.氧氣
(1)氧氣的工業制法一一分離液態空氣法

③實驗裝置:(發生裝置、收集裝置)
發生裝置的選擇依據:反應物的狀態及反應條件。
收集裝置的選擇依據:氣體的水溶性、氣體的密度。具體裝置從略。④操作步驟:a.檢查裝置的氣密性;b.將藥品裝入試管(或錐形瓶或廣口瓶)中;c.從長頸漏斗或分液漏斗中加入過氧化氫溶液;d.收集氧氣。
⑤收集方法:a.排水法;向上排空氣法。
⑥檢驗方法:將帶火星的木條伸入集氣瓶中,若木條立即復燃,證明是氧氣。
⑦驗滿方法:a.用排水法集氣時,如果集氣瓶口有大氣泡冒出,證明瓶中沒有水,即已集滿。b.用向上排空氣法時,用帶火星的木條放在集氣瓶口(注意:不能伸入瓶內),若木條復燃,證明集滿。
(3)氧氣的性質
氧氣是一種化學性質比較活潑的氣體。它在氧化反應中提供氧,具有氧化性,是一種常用的氧化劑。
|
反應物 |
反應物 |
在空氣中燃燒 |
在氧氣中燃燒 |
化學方程式 |
|
木炭(主要成分是碳) |
黑色 固體 |
木炭紅熱、無煙、無焰、生成無色無味的氣體 |
劇烈燃燒,發白光、放熱,生成無色無味可使澄清石灰水變渾濁的氣體 |
C+O2CO2 |
|
硫磺(硫) |
黃色粉末 |
微弱的淡藍色火焰、無煙、生成有刺激性氣味的氣體 |
劇烈燃燒,發出明亮的藍紫色火焰,放熱,生成有刺激性氣味的氣體 |
S+O2SO2 |
|
紅磷 |
暗紅色固體 |
黃色火焰,放熱有大量白煙產生 |
劇烈燃燒,耀眼白光,放熱,生成大量白煙 |
4P+5O22P2O5 |
|
鐵 |
銀白色固體 |
持續加熱發紅,離火后變冷 |
用火柴引燃細鐵絲,劇烈燃燒,放熱,火星四射,生成黑色固體 |
3Fe+2O2Fe3O4 |
|
石蠟 |
白色固體 |
黃白色光,明亮火焰,放熱,稍有黑煙 |
劇烈燃燒,發白光,放熱 |
|

答案:白磷燃燒,容器內產生大量白煙;"4";動能轉化為化學能,白磷的著火點比較低,空氣中氧氣的體積占五分之一。
【例2】某班級的探究小組在學習了催化劑的知識后,他們想研究氧化銅能否在氯酸鉀的受熱分解反應中起催化劑的作用,設計了以下的對比實驗和后續操作:
①任取兩份氯酸鉀,分別放入兩支相同的試管,在其中一份中加入經精確稱量的ng氧化銅粉末。
②將兩份氯酸鉀同時在相同的條件下正確加熱,將放出的氣體通入水中,觀察放出氣體的快慢。
③停止加熱、冷卻,將原先混有氧化銅的反應后的混合物加水溶解,小心過濾,得濾出物,洗滌并干燥。
④觀察濾出物的狀態和顏色。
⑤將濾出物和炭粉混合,在密閉容器中高溫加熱,將反應產生的氣體通入澄清石灰水中,并觀察實驗現象。
(1)以上實驗步驟,有一步不夠嚴密,請指出是哪一步?______________
(2)要達到實驗目的,除改進不嚴密的實驗步驟外,還必須增加一個實驗步驟,這個實驗步驟是______________________________________________。
(3)若用另一個實驗裝置和操作替換第⑤步實驗,也可以達到實驗目的,請把圖中儀器連接成一個符合實驗目的的實驗裝置,這個實驗裝置的接口連接順序是____接____;____接_____;______接_______。(氣流的方向從左往右)
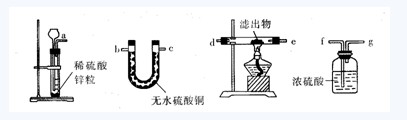
【解析】對比實驗是一項科研活動,要求控制變量,氧氣產生的多少、快慢與很多量有關,如氯酸鉀的質量、溫度、是否有催化劑、加熱的時間等。控制變量就是保證兩份氯酸鉀的質量相等,相同的溫度,同時加熱,只有一個量是可變的,那就是有無CuO。實驗的目的是研究CuO在氯酸鉀反應中的作用。所以第①步任取兩份氯酸鉀進行加熱,人為地增加了變量,當出現不同的效果后,很難找到與結果相關的變量,這是不科學的。
因為是研究CuO的催化作用,除了認真觀察反應速率外,還要研究CuO在化學反應前后質量及化學性質是否改變。研究質量的變化,必須在反應結束后要精確稱量濾出物質量;研究CuO化學性質的變化,必須通過實驗⑤或(3)來驗證。
答案:(1)第①步;(2)精確稱量濾出物質量;(3)afgd(或e)e(或d)b(或c)
歡迎使用手機、平板等移動設備訪問中考網,2025中考一路陪伴同行!>>點擊查看