來源:網(wǎng)絡(luò)資源 2022-11-15 21:23:31

1、原子結(jié)構(gòu)示意圖的認(rèn)識
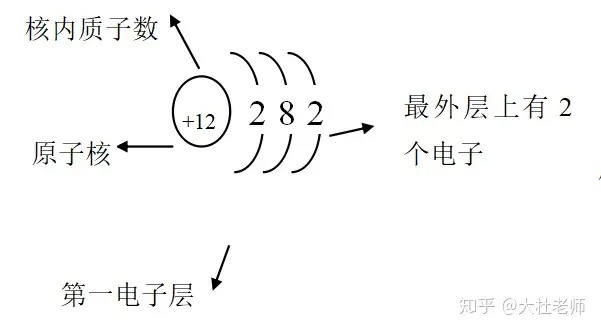
2、在原子中核電荷數(shù)=質(zhì)子數(shù)=核外電子數(shù)
3、原子的質(zhì)量主要集中在原子核上
4、相對原子質(zhì)量≈質(zhì)子數(shù)+中子數(shù)
5、決定元素種類:質(zhì)子數(shù)(核電荷數(shù))
決定元素化學(xué)性質(zhì):最外層電子數(shù)
決定原子的質(zhì)量:原子核
6、說明
(1)最外層電子數(shù)相同其化學(xué)性質(zhì)不一定都相同(Mg,He最外層電子數(shù)為2)
(2)最外層電子數(shù)不同其化學(xué)性質(zhì)有可能相似(He,Ne均為穩(wěn)定結(jié)構(gòu))
![]()
1、定義:具有相同核電荷數(shù)(質(zhì)子數(shù))的一類原子的總稱
注意:
*一種元素與另一種元素的本質(zhì)區(qū)別:質(zhì)子數(shù)不同
*由同種元素組成的物質(zhì)不一定是單質(zhì),(如由O2、O3組成的混合物或金剛石與石墨的混合物)不可能是化合物。
2、表示方法——元素符號——拉丁文名稱的第一個字母大寫
(1)意義:表示某種元素,或者該種元素的一個原子
如:O既表示氧元素又表示氧原子。
(2)有些元素符號還可表示一種單質(zhì) 如Fe、He 、C 、Si
(3)在元素符號前加上數(shù)字后只能有微觀意義,沒有宏觀意義,如3O:只表示3個氧原子
3、元素周期表
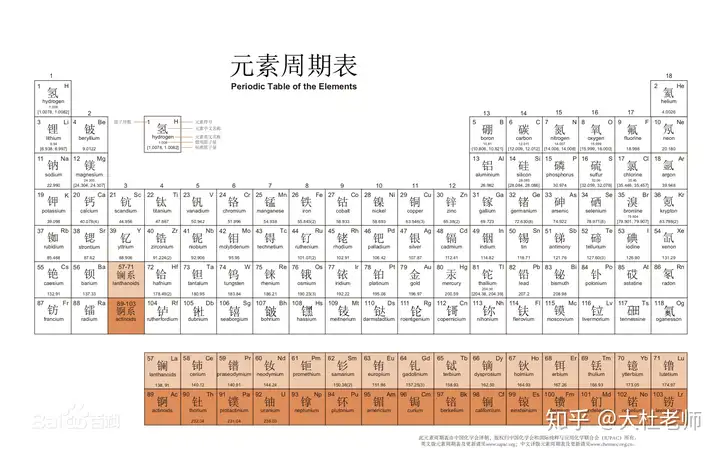
(1)發(fā)現(xiàn)者:門捷列夫
(2)排列依據(jù)

(3)原子序數(shù)=質(zhì)子數(shù)
4、分類
化學(xué)元素是根據(jù)原子核電荷的多少對原子進行分類的一種方法,把核電荷數(shù)相同的一類原子稱為一種元素。一般少于4個,為金屬元素。
一般多于或等于4個,為非金屬元素。
等于8個(氦為2個)為稀有氣體元素。
5、其他
元素之最:地殼:O、Si、Al、Fe
細(xì)胞:O、C、H
![]()
1、定義:帶電的原子或原子團
2、表示方法及意義:如Fe3+ :一個鐵離子帶3個單位正電荷
3、離子結(jié)構(gòu)示意圖的認(rèn)識
注意:
與原子示意圖的區(qū)別:質(zhì)子數(shù)=電子數(shù)則為原子結(jié)構(gòu)示意圖,原子數(shù)≠電子數(shù)為離子結(jié)構(gòu)示意圖
質(zhì)子數(shù)>電子數(shù):則為陽離子,如Al3+
質(zhì)子數(shù)<電子數(shù):則為陰離子,O2-
4、同種元素的原子與離子比較:
①質(zhì)子數(shù)相等
②電子數(shù)及最外層電子數(shù)不同,
③電子層數(shù)可能相同
5、與原子的區(qū)別與聯(lián)系

1、化合價
(1)寫法及意義
Mg:鎂元素化合價為+2價
MgCl2:氯化鎂中鎂元素化合價為+2價
(2)幾種數(shù)字的含義
Fe2+ 每個亞鐵離子帶兩個單位正電荷
3 Fe2+:3個亞鐵離子
2H2O 兩個水分子, 每個水分子含有2個氫原子
(3)化合物中各元素正、負(fù)化合價的代數(shù)和為零
(4)化合價是元素的原子在形成化合物時表現(xiàn)出來的性質(zhì),所以單質(zhì)分子中元素化合價為0
2、化學(xué)式
(1)寫法:
a、單質(zhì):金屬、稀有氣體及大多數(shù)固態(tài)非金屬通常用元素符號表示它們的化學(xué)式;而氧氣、氫氣、氮氣、氯氣等非金屬氣體的分子由兩個原子構(gòu)成,其化學(xué)式表示為O2、H2、N2、Cl2 。
b、化合物:正價在前,負(fù)價在后(NH3,CH4除外)
(2)計算:
a、計算相對分子質(zhì)量=各元素的相對原子質(zhì)量×原子個數(shù)之和
b、計算物質(zhì)組成元素的質(zhì)量比:相對原子質(zhì)量×原子個數(shù)之比
c、計算物質(zhì)中某元素的質(zhì)量分?jǐn)?shù):物質(zhì)中某元素的質(zhì)量/物質(zhì)的質(zhì)量 ×100%
歡迎使用手機、平板等移動設(shè)備訪問中考網(wǎng),2025中考一路陪伴同行!>>點擊查看