來源:網絡資源 2022-12-19 15:49:04
命題分析
1.從考查題型看:離子是否共存的判斷,離子方程式的書寫、正誤判斷主要以選擇題的形式出現。考查氧化還原反應的知識,經常以非選擇題的形式出現。
2.從考查知識點看:離子方程式的正誤判斷、離子能否大量共存所涉及的內容覆蓋面廣,知識容量大。氧化還原反應考查的重點有:了解氧化還原反應的本質,了解氧化劑和還原劑等概念。掌握重要的氧化劑、還原劑之間的反應。能判斷氧化還原反應中電子轉移的方向和數目,并能配平反應方程式。
3.從命題思路上主要有:要求考生能熟練掌握在水溶液中(不同條件下)離子能否大量共存的特點和規律,能正確書寫離子方程式。涉及對陌生反應的理解,涉及對陌生反應中氧化劑、還原劑以及氧化產物、還原產物等的判斷,能書寫或配平陌生的氧化還原反應的離子方程式等。
策略
1.物質分類的方法有多種,依據不同的標準對物質有不同的分類,高考中往往會綜合考查物質的分類,膠體內容有考查膠體的基礎知識與科技、生活、生產相結合的問題的趨勢。
2.氧化還原反應方面的高考命題考查基本概念的題目較少,側重考查書寫在陌生環境下氧化還原反應方程式,特別是近幾年出現的氧化還原滴定更是將氧化還原反應知識的考查提升了一個層次。為此,對于氧化還原反應知識的復習,一定要在理清基本概念間關系的前提下,掌握好雙線橋法在電子守恒計算、配平方面的應用,特別是涉及氧化還原反應的計算題,巧用電子守恒往往可起到事半功倍之效。
3.離子反應也是歷年高考的命題熱點之一。近幾年的全國卷中,單獨考查離子反應的題目不多,但卷中多個地方又會考查離子反應,如常見離子的檢驗、陌生環境下離子型氧化還原反應方程式的書寫等,這些往往出現在實驗選擇題、實驗綜合題和化學工藝流程圖題中。所以在復習這部分知識時,要有意識地研究高考題的考向特點,有針對性地將元素化合物知識、氧化還原反應與離子反應知識融合在一起進行訓練,以提升做綜合題的能力。
物質的分類和性質
一、元素與物質
1.元素的概念
具有相同核電荷數(即質子數)的同一類原子的總稱。
2.元素的存在形態
3.元素與物質的關系
(1)物質都是由元素組成的,每一種元素都能自身組成物質,即單質。
(2)絕大多數元素都能與其他種類的元素組成物質,即化合物。
二、物質的分類
1.分類的概述
(1)分類是學習和研究化學物質及其變化的一種常用科學方法。
(2)分類應依據事先設定的“標準”進行,“標準”不同,分類方法也不相同。
2.分類法
常用的兩種是交叉分類法和樹狀分類法。
由于物質分類可以有不同的標準,也就是說對某一物質而言就可以在不同的分類標準下“扮演不同的角色”。
(1)交叉分類法的應用示例
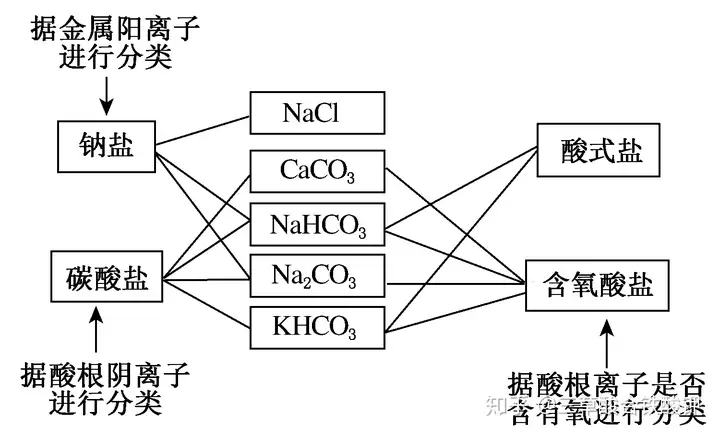
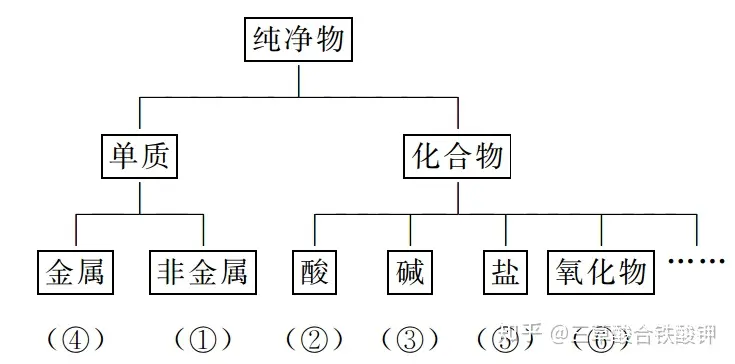
(2)樹狀分類法的應用示例
①硫黃 ②次氯酸 ③NH3·H2O ④銅
⑤硫酸氫鈉 ⑥NO2
三、物質的性質和變化
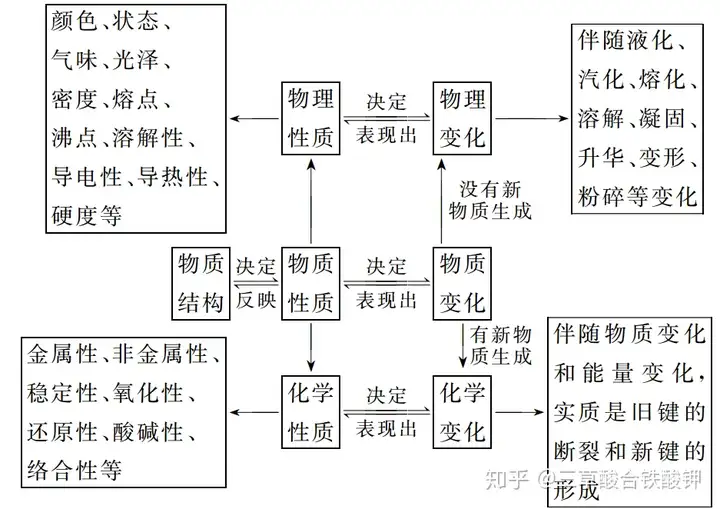
化學變化與物理變化的聯系:化學變化中一定有物理變化,而物理變化中不一定有化學變化。
有關同素異形體要注意的三個方面
1.同素異形體的物理性質不同。
2.同素異形體的化學性質相似。
3.同素異形體之間可以相互轉化,屬于化學變化,但不屬于氧化還原反應。
三個判斷
1.元素與單質的判斷
一種元素組成的物質可能是單質,但是一種元素不一定只能形成一種單質。如O2和O3,金剛石(C)、石墨、C60等,它們之間具有同素異形體關系,不是同一種分子,混合在一起應屬于混合物。
2.氧化物的類別判斷
(1)酸性氧化物不一定是非金屬氧化物,如Mn2O7;非金屬氧化物也不一定是酸性氧化物,如CO、NO。
(2)堿性氧化物一定是金屬氧化物,但金屬氧化物不一定是堿性氧化物,如Mn2O7是酸性氧化物,Al2O3是兩性氧化物。
(3)酸性氧化物、堿性氧化物形成對應的酸、堿時,元素化合價不變。
(4)酸性氧化物、堿性氧化物不一定都能與水反應生成相應的酸、堿(如SiO2、Fe2O3)。
3.物理變化和化學變化的判斷方法
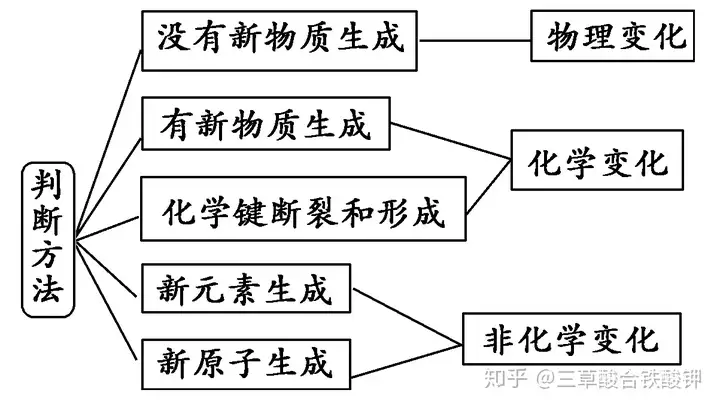
(1)常見的物理變化:①物質三態變化;②金屬導電;③蒸餾和分餾;④揮發、升華;⑤吸附、鹽析、滲析;⑥溶解、潮解;⑦焰色反應。
(2)常見的化學變化:①風化、硫化、老化、裂化、硝化、鈍化、硬化、氫化、水化、皂化、炭化、催化、酯化、同素異形體的相互轉化;②脫水;③干餾、爆炸;④電解、電鍍、電化學腐蝕、電解質溶液導電。
1.純凈物和混合物的比較
純凈物:有固定的組成和結構,有固定的熔、沸點,保持一種物質的性質
混合物:無固定的組成和結構,無固定的熔、沸點,保持原有物質各自的性質
2.常見的混合物
(1)氣體混合物:空氣、水煤氣(CO和H2)、爆鳴氣(H2和O2)、天然氣(主要成分是CH4)、焦爐氣(主要成分是H2和CH4)、高爐煤氣、石油氣、裂解氣。
(2)液體混合物:氨水、氯水、王水、天然水、硬水、軟水、水玻璃、福爾馬林、濃H2SO4、鹽酸、汽油、植物油、膠體。
(3)固體混合物:大理石、堿石灰、漂白粉、高分子化合物、玻璃、水泥、合金、鋁熱劑。
1.純凈物和混合物的比較分類標準不同,物質的類別不同
在化合物中可按多種分類標準對物質進行分類,如
按不同的分類標準
按化合物的性質酸、堿、鹽、氧化物等
按化合物中化學鍵的類別離子化合物、共價化合物
按在水溶液或熔融狀態下是否導電電解質、非電解質
分散系、膠體
一、區分三種分散系
1.分散系
把一種(或多種)物質分散在另一種(或多種)物質中所得到的體系。
2.分類
如圖所示,把分散系分為溶液、膠體和濁液的標準是分散質粒子直徑的大小。其中膠體粒子直徑的大小為1~100_nm。

3.三種分散系的比較

二、掌握膠體的性質及Fe(OH)3膠體的制備
1.膠體的性質及應用
(1)丁達爾效應
可見光束通過膠體時,會出現一條光亮的“通路”現象。
應用:鑒別溶液和膠體。
(2)聚沉
膠體粒子聚集成較大顆粒,從而形成沉淀從分散劑里析出的過程叫作聚沉。
使膠體聚沉的方法有①加入電解質;②加入與膠粒帶相反電荷的膠體;③加熱。
應用:三角洲的形成;明礬、鐵鹽溶液凈水;鹽鹵制豆腐。
2.Fe(OH)3膠體的制備
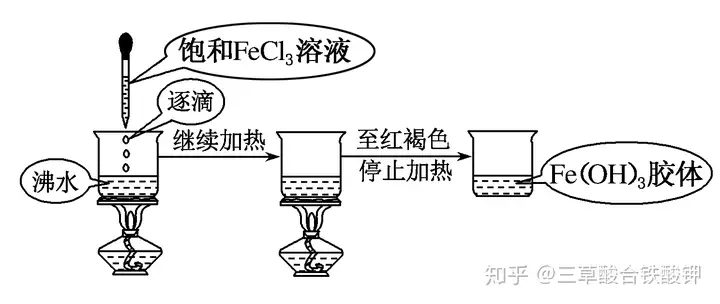
(1)反應原理:FeCl3+3H2O△(=====)Fe(OH)3(膠體)+3HCl。
(2)操作步驟:向沸水中逐滴加入5~6滴FeCl3飽和溶液,繼續煮沸至溶液呈現紅褐色。
(3)注意事項
①加熱至溶液呈紅褐色后停止加熱。
②不能用自來水,不能攪拌。
1.膠體不帶電,膠體中的膠粒能夠吸附體系中的帶電離子而使膠粒帶電荷,但整個分散系仍呈電中性。
2.膠體中的分散質微粒能透過濾紙,但不能透過半透膜,因此可用過濾的方法分離膠體和濁液,用滲析的方法分離膠體和溶液中的分散質。
3.書寫制備Fe(OH)3膠體化學方程式的四個易錯點
(1)用“=”
(2)Fe(OH)3分子式后注明膠體而不使用“↓”符號。
(3)反應條件是“△”。
(4)HCl后不能標“↑”符號。
離子反應
電解質及其電離
1.電解質和非電解質
(1)電解質:在水溶液里或熔融狀態下能夠導電的化合物。
(2)非電解質:在水溶液里以及熔融狀態下都不能導電的化合物。
2.強電解質和弱電解質
(1)強電解質:在水溶液中能完全電離的電解質。
(2)弱電解質:在水溶液中部分電離的電解質。
3.電離及電離方程式
(1)電離:電解質在水溶液中或熔融狀態下產生自由移動離子的過程,電離過程可以用電離方程式表示。
(2)電離方程式
①強電解質:完全電離,用“=”表示。
例如NaCl===Na++Cl-。
②弱電解質:部分電離,用“可逆符號”表示。
例如NH3·H2O??NH4(+)+OH-。
③多元弱酸分步電離,一般以第一步電離為主。
例如H2CO3??H++HCO3(-)。
④多元弱堿也分步電離,但一步寫完。
例如Fe(OH)3??Fe3++3OH-。
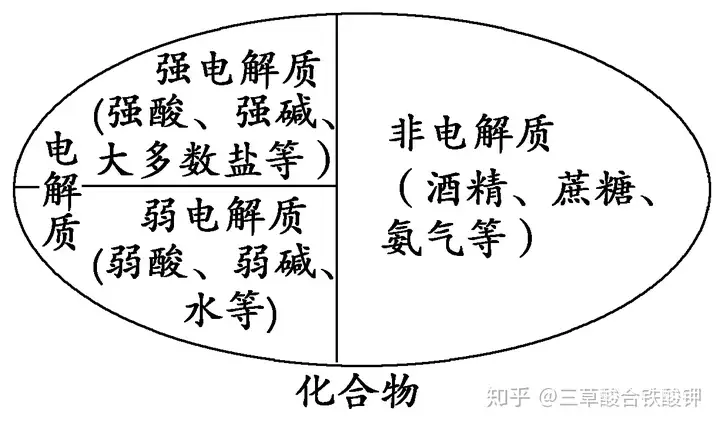
一種關系
電解質、非電解質、強電解質、弱電解質之間的關系
電解質的深化拓展
1.電解質不一定能導電,如固態NaCl、液態HCl等;能導電的物質不一定是電解質,如鐵、鋁等金屬單質。
2.非電解質不導電,但不導電的物質不一定是非電解質,如金剛石、單質硫等一些非金屬單質。
3.電解質和非電解質都是化合物,單質和混合物既不是電解質也不是非電解質。
4.電解質一定是指自身電離生成離子的化合物,有些化合物的水溶液能導電,但溶液中的離子不是它自身電離產生的,不屬于電解質,如CO2、SO2、NH3、SO3等非電解質,它們與水反應生成的產物H2CO3、H2SO3、NH3·H2O、H2SO4自身能電離,是電解質。
電離方程式書寫“三原則”
(1)符合客觀事實,不能隨意書寫。離子符號和原子團的不可拆分性(注意:NaHSO4在水中完全電離,生成Na+、H+、SO4(2-))。
(2)質量守恒
“=”左右兩邊原子種類、數目不變。
(3)電荷守恒
電離方程式“=”左右兩邊的電荷總數相等。
離子反應 離子方程式
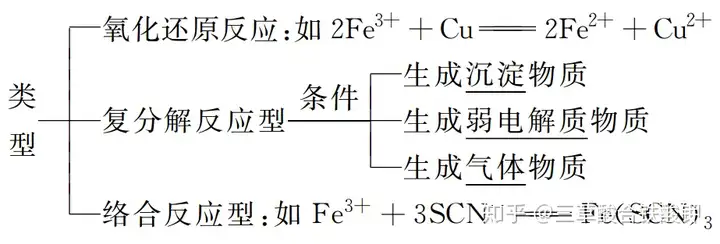
1.離子反應
(1)概念:有離子參加或生成的化學反應。
(2)離子反應的類型
2.離子方程式
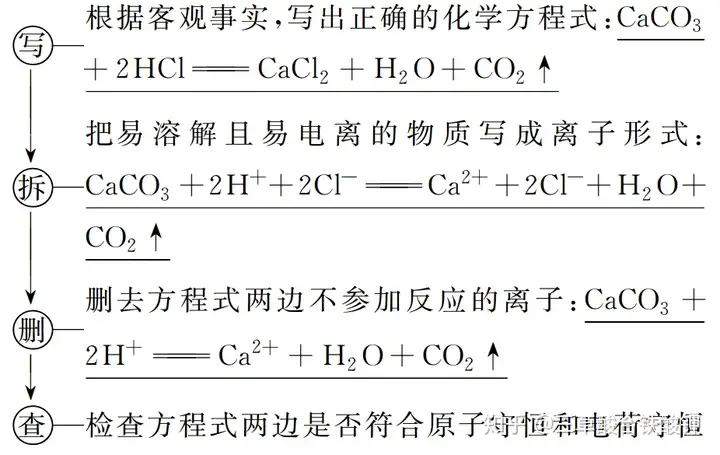
(1)意義:不僅表示某一個具體的化學反應,還表示同一類型的離子反應,如氫氧化鈉溶液和鹽酸反應、氫氧化鈣溶液和硝酸反應的離子方程式,都可用離子方程式H++OH-===H2O來表示。
(2)書寫步驟:以CaCO3與鹽酸的反應為例。
離子方程式正誤判斷的審題要點

“量比”陷阱
在離子方程式正誤判斷中,學生往往忽略相對量的影響,命題者往往設置“離子方程式產物正確,但不符合相對量”的陷阱。突破“陷阱”的方法一是審準“相對量”的多少。
與“量”有關的離子方程式的書寫
1.連續反應型離子反應
反應生成的離子因又能跟剩余(過量)的反應物繼續反應而跟用量有關。如:OH-通入CO2(――→)CO3(2-)CO2(――→)HCO3(-);Al3+OH-(――→)Al(OH)3OH-(――→)AlO2(-);AlO2(-)H+(――→)Al(OH)3H+(――→)Al3+;Fe強氧化劑(――→)Fe3+Fe(――→)Fe2+。
2.先后型離子反應
一種反應物中兩種或兩種以上的離子都能跟另一種反應物反應,產物因反應次序以及反應物的量有關,如FeBr2與Cl2反應。
3.配比型離子反應
兩種反應物反應時,反應物中有兩種或兩種以上離子反應時,當一種組成離子恰好完全反應時,另一種組成離子不能恰好完全反應(有剩余或不足),產物與反應物的用量有關,如Ca(OH)2與NaHCO3反應。
連續型離子方程式的書寫方法
根據反應條件先分析反應物是否存在過量,再根據反應原理書寫。若無過量,則發生第一步反應,若過量,則反應物發生兩步反應,寫離子方程式時則不必寫出第一步反應的中間產物,按終態產物寫離子反應方程式。如多元弱酸或酸酐(如CO2或SO2)與強堿溶液反應,若CO2(或SO2)少量,產物為正鹽;若CO2(或SO2)過量,產物為酸式鹽;多元弱酸正鹽與強酸反應,先生成酸式鹽,酸式鹽再進一步與酸反應,生成強酸鹽和弱酸。
先后型離子反應方程式的書寫方法
(1)復分解反應型:依據“競爭反應、強者優先”的規律明確離子反應的先后順序,再按反應原理書寫,如向含有OH-、CO3(2-)、AlO2(-)的溶液中,逐滴加入稀鹽酸至過量,因結合質子的能力OH->AlO2(-)>CO3(2-),則反應的離子方程式依次為OH-+H+===H2O、AlO2(-)+H++H2O===Al(OH)3↓、CO3(2-)+2H+===H2O+CO2↑、Al(OH)3+3H+===Al3++3H2O。
(2)氧化還原型:①強氧化劑遇到兩種還原性離子時,應注意氧化劑是否過量,若氧化劑不足,將還原性離子按還原性強弱排序,誰強誰先反應。如將少量的Cl2通入FeBr2溶液中,離子方程式為2Fe2++Cl2===2Fe3++2Cl-;若Cl2過量,則離子方程式為2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-。②在不明確離子反應的先后順序時,可用假設定序法,如FeBr2溶液與Cl2反應,可假設Cl2先與Br-反應,則生成的溴單質還要氧化Fe2+生成Fe3+,這樣即可確定Cl2先與Fe2+后與Br-反應,然后再根據量的關系書寫即可。
配比型離子反應方程式的書寫方法
配比型離子反應按照“以少定多”的原則進行書寫,即先根據題給條件判斷“少量物質”,以少量物質的離子計量數(充分反應)確定所需“過量物質”的離子數目。如向Ca(HCO3)2溶液中加入過量NaOH溶液的離子方程式的書寫方法為
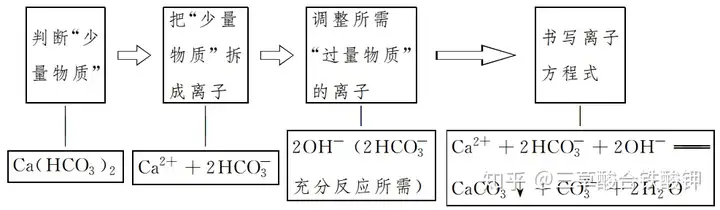
離子共存
一、離子共存的本質
幾種離子在同一溶液中能大量共存,就是指離子之間不發生任何反應;若離子之間能發生反應,則不能大量共存。
二、離子不能大量共存的四種類型
1.復分解反應型
(1)生成難溶物或微溶物的離子不能大量共存
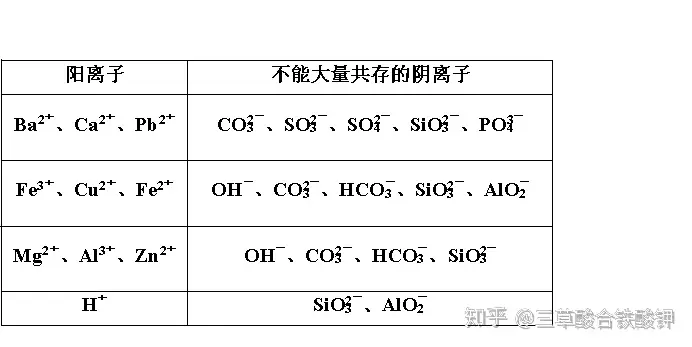
(2)生成氣體及揮發性物質的離子不能大量共存

(3)生成難電離物質(水、弱酸、一水合氨等)的離子不能大量共存
①H+與CH3COO-、CO3(2-)、S2-、SO3(2-)等生成弱酸不能大量共存。
②OH-與NH4(+)(稀溶液)生成弱堿不能大量共存。
③H+與OH-生成水不能大量共存。
④多元弱酸的酸式酸根離子(如HCO3(-)、HSO3(-)、HS-、H2PO4(-)、HPO4(2-)等)與H+、OH-均不能大量共存。
2.氧化還原反應型
具有較強氧化性的離子與具有較強還原性離子,會發生氧化還原反應而不能大量共存。(3)生成難電離物質(水、弱酸、一水合氨等)的離子不能大量共存
①H+與CH3COO-、CO3(2-)、S2-、SO3(2-)等生成弱酸不能大量共存。
②OH-與NH4(+)(稀溶液)生成弱堿不能大量共存。
③H+與OH-生成水不能大量共存。
④多元弱酸的酸式酸根離子(如HCO3(-)、HSO3(-)、HS-、H2PO4(-)、HPO4(2-)等)與H+、OH-均不能大量共存。
2.氧化還原反應型
具有較強氧化性的離子與具有較強還原性離子,會發生氧化還原反應而不能大量共存。

3.水解相互促進型
當弱酸的酸根與弱堿的陽離子同時存在于水溶液中時,弱酸的酸根水解生成的OH-與弱堿的陽離子水解生成的H+反應生成水,從而使兩種離子的水解互相促進而使平衡向水解方向移動,甚至完全反應。如Al3+與CO3(2-)不能共存。
2Al(OH)3↓+3CO2↑(+3H2O===)+OH-CO3(2-)+H2O??HCO3(-)常見的因發生相互促進的水解反應而不能大量共存的離子如下:
(1)Al3+與CO3(2-)、HCO3(-)、S2-、HS-、AlO2(-)、SiO3(2-)。
(2)Fe3+與CO3(2-)、HCO3(-)、AlO2(-)、SiO3(2-)。
4.絡合反應型
離子間因發生絡合反應而不能大量共存,中學常見的反應有
(1)Fe3+與SCN-因生成Fe(SCN)3而不能大量共存。
(2)Ag+與NH3·H2O因生成[Ag(NH3)2]+而不能大量共存。
(3)Cu2+與NH3·H2O因生成[Cu(NH3)4]2+而不能大量共存。
(4)Zn2+與NH3·H2O因生成[Zn(NH3)4]2+而不能大量共存。
注意:解答離子共存類題目時,除了非常熟悉離子不能大量共存的四大反應類型外,還要特別注意題目中的隱含條件,從而快速準確破解離子共存題。
氧化還原反應
氧化還原反應及其相關概念
一、氧化還原反應
1.概念
某些物質被氧化,同時某些物質被還原的反應。
2.特征
有元素化合價變化(判斷依據)。
3.本質
電子轉移(包括電子的得失、共用電子對的偏移)。
4.關系
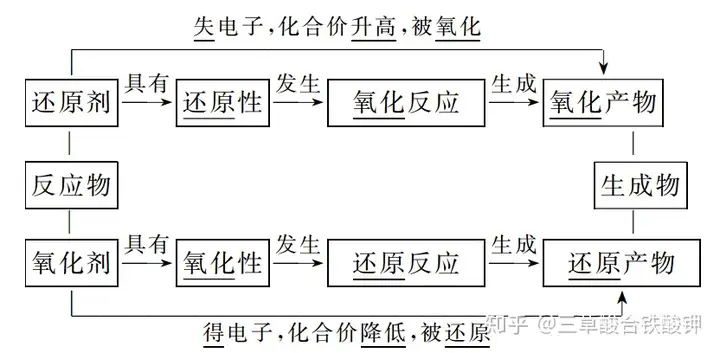
例如對于反應MnO2+4HCl(濃)△(=====)MnCl2+Cl2↑+2H2O
①MnO2在反應中得到電子,所含元素的化合價降低,被還原,發生還原反應,作氧化劑。
②HCl在反應中失去電子,所含元素的化合價升高,被氧化,發生氧化反應,作還原劑。
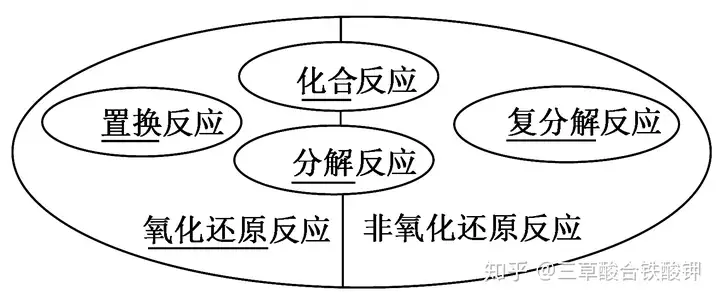
5.氧化還原反應與四種基本反應類型的關系
二、常見的氧化劑和還原劑
1.常見的氧化劑
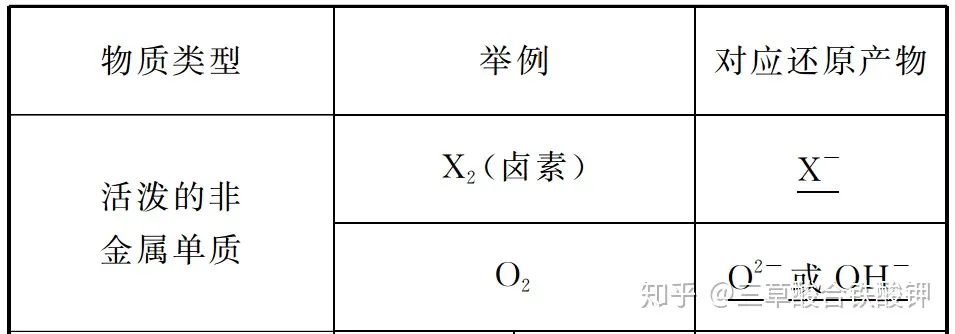
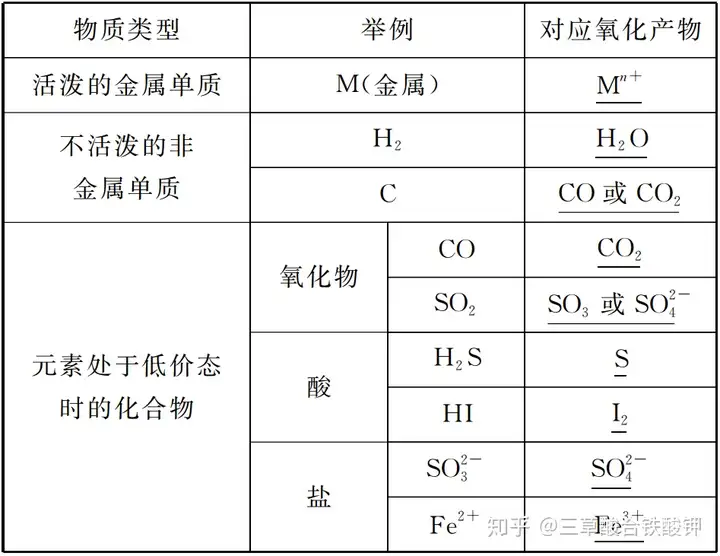
2.常見的還原劑
1.氧化還原反應概念間的關系:熟記六個字:“升、失、氧;降、得、還”[元素化合價升高(降低)、失(得)電子,發生氧化(還原)反應]。
2.熟記常見元素的化合價:一價氫、鉀、鈉、氟、氯、溴、碘、銀;二價氧、鈣、鋇、鎂、鋅;三鋁、四硅、五價磷;說變價也不難,二三鐵、二四碳、二四六硫都齊全;銅汞二價最常見。
3.有單質參與或生成的反應不一定屬于氧化還原反應,如3O2放電(=====)2O3。
4.牢記一些特殊物質中元素的化合價(單位:價)
CuFeS2:Cu +2Fe +2S -2
K2FeO4:Fe +6Li2NH、LiNH2、AlN:N -3
Na2S2O3:S +2MO2(+):M +5
C2O4(2-):C +3HCN:C +2N -3
CuH:Cu +1H -1
FeO4(n-):Fe +(8-n)Si3N4:Si +4N -3
三個誤區
1.認為氧化性和還原性的強弱取決于得失電子的多少
氧化性和還原性的強弱只取決于電子得失的難易,而與電子得失的多少無關。
如每摩爾濃硝酸還原為NO2時得到1 mol電子,每摩爾稀硝酸還原為NO時得到3 mol電子,但濃硝酸的氧化性卻比稀硝酸強。
2.認為只要元素化合價存在差異就可發生氧化還原反應
同種元素不同價態的化合物間的氧化還原反應遵循以下規律:
(1)相鄰價態之間不發生氧化還原反應。如SO2和濃硫酸不反應。
(2)相間價態,在一定條件下能發生反應生成中間價態。如2FeCl3+Fe===3FeCl2。
3.認為同種元素不同價態的化合物的氧化性(還原性)強弱只與元素化合價的高低有關
實際上,除此之外還與化合物的穩定性有關。如次氯酸(HClO)中氯的價態比高氯酸(HClO4)中氯的價態低,但次氯酸不穩定,氧化性卻比高氯酸強。另外最高價態的物質也不一定都表現強氧化性,如H3PO4。
氧化性、還原性強弱的判斷
一、氧化性、還原性的概念、理解及判斷
1.氧化性是指物質得電子的性質(或能力);還原性是指物質失電子的性質(或能力)。
2.氧化性、還原性的強弱取決于物質得、失電子的難易程度,與得、失電子的數目無關,如Na-e-===Na+、Al-3e-===Al3+,但根據金屬活動性順序表,Na比Al活潑,更易失去電子,所以Na比Al的還原性強。
3.從元素的價態考慮:最高價態——只有氧化性,如Fe3+、H2SO4、KMnO4等;最低價態——只有還原性,如金屬單質、Cl-、S2-等;中間價態——既有氧化性又有還原性,如Fe2+、S、Cl2等。
二、氧化性、還原性強弱的比較方法
氧化性、還原性的強弱主要取決于物質得失電子的難易程度,與得失電子的數目無關。另外還跟反應的條件,如溶液的酸堿性、濃度、溫度等因素有關,可依據以下幾個方面判斷:
1.依據元素周期表
(1)同周期從左到右,金屬元素單質的還原性逐漸減弱,對應陽離子的氧化性逐漸增強;非金屬元素單質的氧化性逐漸增強,對應陰離子的還原性逐漸減弱。
(2)同主族從上到下,金屬元素單質的還原性逐漸增強,對應陽離子的氧化性逐漸減弱;非金屬元素單質的氧化性逐漸減弱,對應陰離子的還原性逐漸增強。
2.依據金屬、非金屬活動性順序
(1)依據金屬活動性順序

3.依據反應原理
氧化劑+還原劑―→還原產物+氧化產物
氧化性:氧化劑>氧化產物
還原性:還原劑>還原產物
4.依據反應條件及反應的劇烈程度
反應條件要求越低,反應越劇烈,對應物質的氧化性或還原性越強,如是否加熱、有無催化劑及反應溫度高低和反應物濃度大小等。
例如:2KMnO4+16HCl(濃)===2KCl+2MnCl2+5Cl2↑+8H2O,
MnO2+4HCl(濃)△MnCl2+Cl2↑+2H2O,
4HCl+O2催化劑2H2O+2Cl2,
由上述反應條件的不同,可判斷氧化性:
KMnO4>MnO2>O2。
5.依據氧化還原反應的程度
(1)相同條件下,不同氧化劑使同一種還原劑被氧化程度大的,其氧化性強。例如
2Fe+3Cl2點燃2FeCl3,Fe+S△FeS,
氧化性:Cl2>S。
(2)相同條件下,不同還原劑使同一種氧化劑被還原程度大的,其還原性強。例如
Cu+2Fe3+===Cu2++2Fe2+,
3Zn+2Fe3+===3Zn2++2Fe,
還原性:Zn>Cu。
6.依據電化學原理
原電池中,負極物質的還原性一般強于正極物質;用惰性電極電解混合溶液時,在陰極先放電的陽離子的氧化性強,在陽極先放電的陰離子的還原性強。
7.某些氧化劑的氧化性或還原劑的還原性與下列因素有關
溫度:如熱的濃硫酸的氧化性比冷的濃硫酸的氧化性強。
濃度:如濃硝酸的氧化性比稀硝酸的強。
酸堿性:如KMnO4溶液的氧化性隨溶液酸性的增強而增強。
四個不
1.元素處于最高價態時只有氧化性,但不一定有強氧化性,如Na+、SO4(2-);同理,元素處于最低價態時也不一定具有強還原性。
2.對于一種物質既作氧化劑又作還原劑的反應,如Cl2+H2O??HClO+HCl,不能根據反應方程式判斷物質氧化性、還原性的強弱。
3.依據金屬活動性順序判斷陽離子的氧化性強弱時,要注意Fe對應的陽離子是Fe2+,而不是Fe3+。
4.含有同種元素不同價態的物質,價態越高其氧化性不一定越強。如氧化性HClO>HClO4。
假設法判斷氧化還原反應能否進行
已知物質的氧化性或者還原性的強弱關系,判斷某一氧化還原反應能否發生時可采用假設法。
先假設反應成立
⇩
然后根據氧化劑的氧化性>氧化產物的氧化性,還原劑的還原性>還原產物的還原性的規律,列出假設反應中的上述關系
⇩
結合題干條件判斷該結論是否符合事實。符合事實,則反應成立;反之,則不成立
守恒法解題的“3步流程”

氧化還原反應的配平及表示方法
1.氧化還原反應方程式的配平
(1)配平方法
①一標:標出反應前后變價元素的化合價。
②二等:反應中升價總數和降價總數相等。
③三定:確定化合價發生變化的物質的化學計量數。
④四平:用觀察法配平其他各物質的化學計量數。
⑤五查:檢查反應前后是否遵循質量守恒和電子守恒。
(2)實例:銅與濃H2SO4發生反應的化學方程式:
2H2SO4(濃)+Cu△(=====)CuSO4+SO2↑+2H2O。
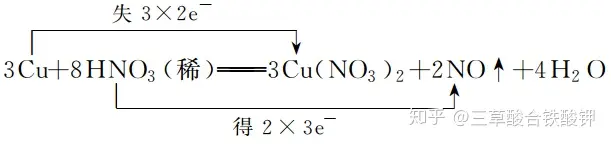
2.雙線橋法
(1)表示方法:箭頭由反應物指向生成物的對應元素,并在線橋上標明電子和“得”及“失”字樣。
(2)實例:Cu與稀硝酸反應過程中電子轉移的方向和數目可表示為
3.單線橋法
(1)表示方法:箭頭由失電子原子指向得電子原子,線橋上只標轉移電子數目,不標電子的“得”“失”字樣。
(2)實例:Cu與濃HNO3反應過程中電子轉移的方向和數目可表示為
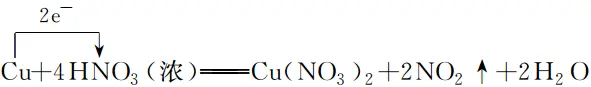
1.注意特殊物質中元素的化合價,如CuFeS2中銅、鐵元素的化合價都為+2價,硫元素的化合價為-2價;FeS2中硫元素的化合價為-1價;K2FeO4中鐵元素的化合價為+6價等。
2.配平化學方程式時,化學計量數“1”也必須填寫在空格里。
3.依據電子得失守恒列等式時不要忽略變價原子的個數。
1.注意特殊物質中元素的化合價,如CuFeS2中銅、鐵元素的化合價都為+2價,硫元素的化合價為-2價;FeS2中硫元素的化合價為-1價;K2FeO4中鐵元素的化合價為+6價等。
2.配平化學方程式時,化學計量數“1”也必須填寫在空格里。
3.依據電子得失守恒列等式時不要忽略變價原子的個數。
我的總結
在全國卷中,考題的情景模型有如下4種,需要理解和應用的解題方法有如下4條。

氧化還原反應方程式的配平
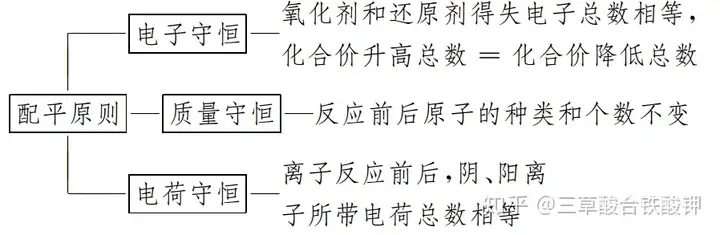
1.配平的三大守恒原則
2.配平的三種方法技巧
(1)正向配平法:適合反應物分別是氧化劑、還原劑的反應,配平按以下4步進行。

(2)逆向配平法:適用于一種元素的化合價既升高又降低的反應和分解反應中的氧化還原反應。先確定生成物的化學計量數,然后再確定反應物的化學計量數。
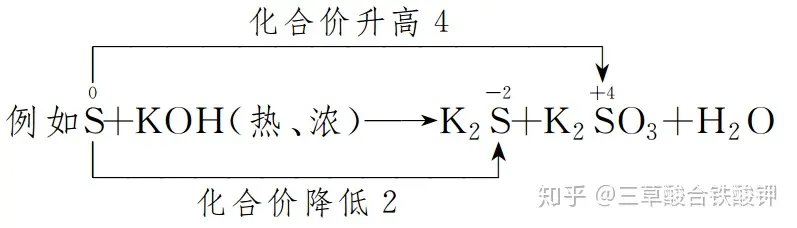
由于S的化合價既升又降,而且升降總數要相等,所以K2S的化學計量數為2,K2SO3的化學計量數為1,然后確定S的化學計量數為3。
(3)奇數配偶法:適用于物質種類少且分子組成簡單的氧化還原反應。如S+C+KNO3―→CO2↑+N2↑+K2S,反應物KNO3中三種元素原子數均為奇數,而生成物中三種元素的原子數均為偶數,故可將KNO3乘以2,然后用觀察法配平得:S+3C+2KNO3===3CO2↑+N2↑+K2S。
1.配平方法
先用“化合價升降法”配平含有變價元素的物質的化學計量數,然后再根據原子守恒進行配平。
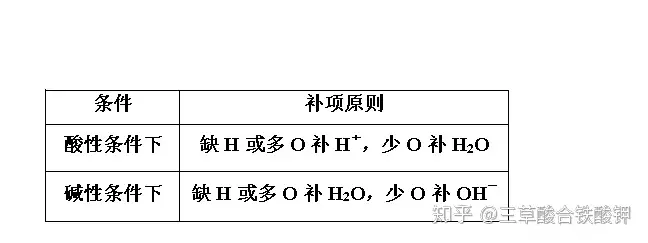
2.補項原則
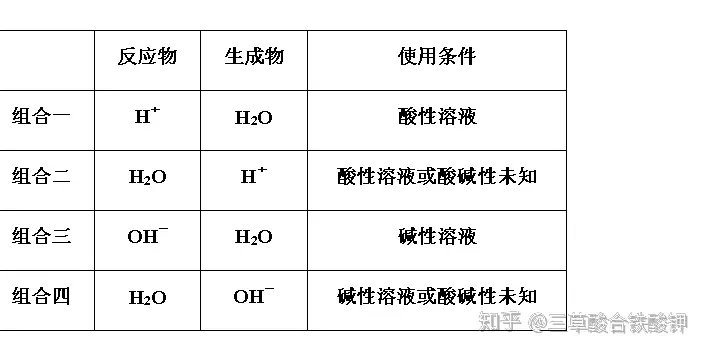
3.組合方式
信息型氧化還原反應方程式的書寫

歡迎使用手機、平板等移動設備訪問中考網,2025中考一路陪伴同行!>>點擊查看