來源:網絡資源 2022-12-19 15:50:08
物質的檢驗
考綱要求:
1.了解化學實驗是科學探究過程中的一種重要方法。
2.了解化學實驗室常用儀器的主要用途和使用方法。
3.掌握化學實驗的基本操作,能識別藥品安全使用標志。
題型一 定性分析型
1.核心知識必備
(1)常考氣體的定性檢驗方法:包括Cl2、NH3、SO2、HCl、CO2、NO等。
(2)常考陽離子的檢驗方法,包括NH、Fe3+、Fe2+、Al3+、Cu2+、Ag+等。
(3)常考陰離子的檢驗方法,包括Cl-、Br-、I-、SO、CO、SO等。
2.物質檢驗的一般思路
根據物質性質,使被檢驗物質與加入的試劑作用,轉變為某種已知物質,或產生某種特殊現象,從而確定該物質的存在(物質性質也是幫助檢驗的重要依據)。常見的特殊現象有:
(1)生成氣體。能夠生成氣體的離子很多,生成的氣體的性質也常有相似之處,判斷時要注意排除干擾離子。
(2)生成沉淀。許多金屬陽離子或酸根陰離子都可生成具有特殊顏色、特殊性質的沉淀,但同時也應注意排除干擾離子。
(3)顯現特殊顏色。特殊顏色的出現或消失并配合特殊試劑,是鑒別物質的常見方法,如KSCN檢驗Fe3+、淀粉檢驗I2等。
特別提醒 (1)能使品紅溶液褪色的氣體有:SO2、Cl2、O3等,其中SO2只能使石蕊溶液變紅,而不能使其褪色,Cl2、O3最終可使石蕊溶液褪色。
(2)在中學化學中,氨氣是唯一能使濕潤的紅色石蕊試紙變藍的氣體。
(3)不溶于水也不溶于硝酸的白色沉淀是AgCl或BaSO4等。
(4)NO氣體的檢驗方法是向無色氣體中通入空氣(或O2),看氣體是否變紅棕色。
[典例剖析] [2015·全國卷Ⅰ,(1)(2)]草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的鈉鹽和鉀鹽易溶于水,而其鈣鹽難溶于水。草酸晶體(H2C2O4·2H2O)無色,熔點為101 ℃,易溶于水,受熱脫水、升華,170 ℃以上分解。回答下列問題:
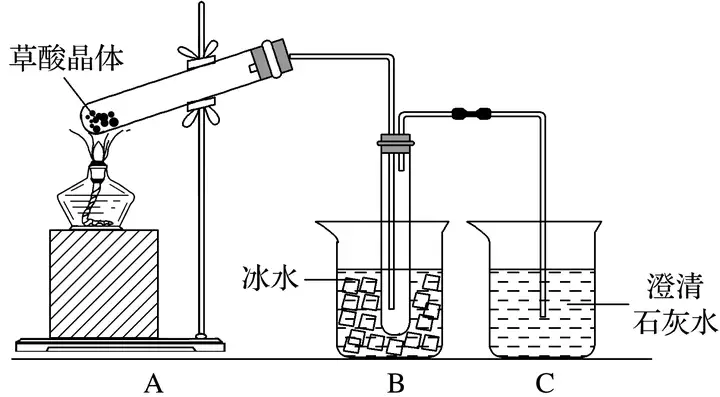
(1)甲組同學按照如圖所示的裝置,通過實驗檢驗草酸晶體的分解產物。裝置C中可觀察到的現象是_______________________________________________________________
________________________________________________________________________,由此可知草酸晶體分解的產物中有________。裝置B的主要作用是________________________。
(2)乙組同學認為草酸晶體分解的產物中還有CO,為進行驗證,選用甲組實驗中的裝置A、B和下圖所示的部分裝置(可以重復選用)進行實驗。
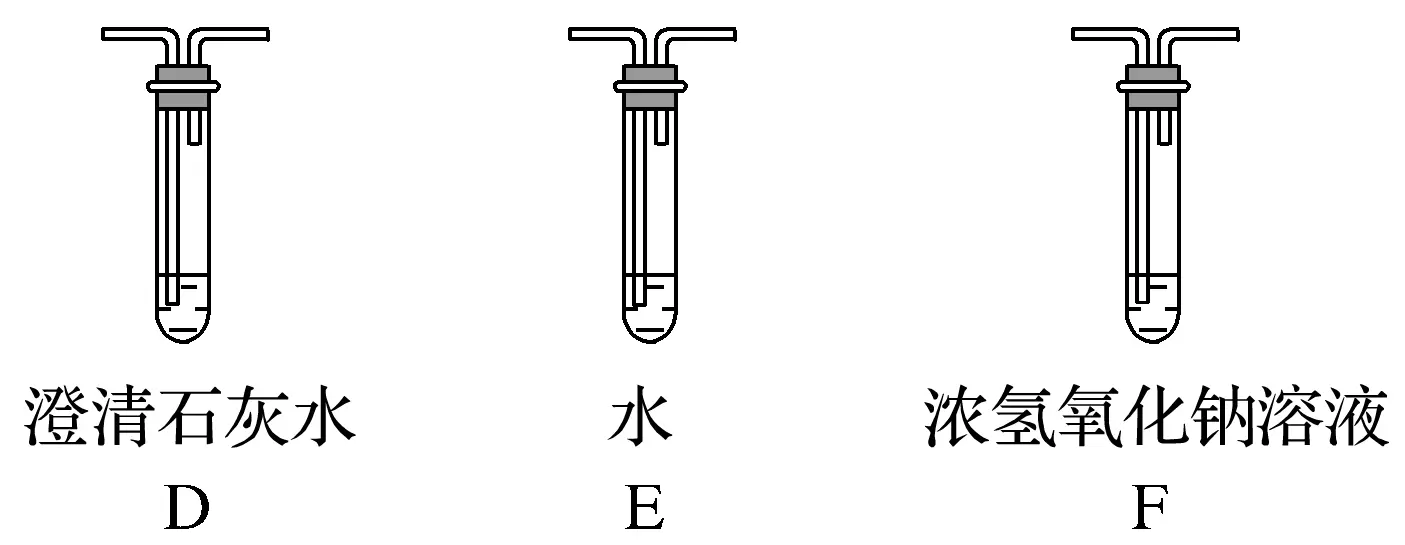
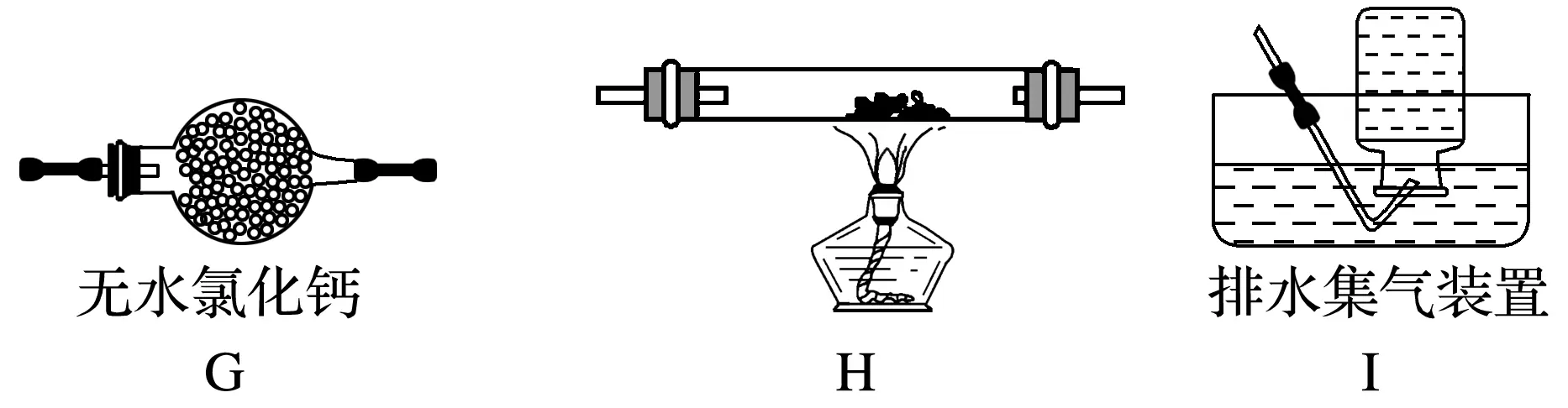
①乙組同學的實驗裝置中,依次連接的合理順序為A、B、________。裝置H反應管中盛有的物質是________。
②能證明草酸晶體分解產物中有CO的現象是______________________________________
______________________________________________________________________________
________________________________________________________________________。
[思路引導]
第(1)問考查CO2的檢驗方法,CO2能使澄清石灰水變渾濁,還應注意題干中草酸的性質,草酸蒸氣對CO2的檢驗有干擾作用。第(2)①問考查該實驗中檢驗CO時干擾因素CO2的排除,檢驗CO氣體,應先在H裝置中進行CO還原CuO的反應,氣體進入H裝置前需除去CO中的CO2氣體并且檢驗CO2是否除盡,從H裝置中導出的氣體需用澄清石灰水檢驗CO2氣體的存在,說明是CO還原CuO。第(2)②考查CO檢驗時現象描述的全面性,CO還原CuO時,黑色的CuO變成紅色的單質Cu,且CO的氧化產物是CO2。
答案 (1)有氣泡逸出,澄清石灰水變渾濁 CO2 冷凝(水蒸氣、草酸等),防止草酸進入裝置C反應生成沉淀,干擾CO2的檢驗
(2)①F、D、G、H、D、I CuO(氧化銅)
②前面澄清石灰水無現象,H中黑色粉末變紅色,其后的D中澄清石灰水變渾濁

1.(2017·江西三校聯考)某研究小組為探究足量鋅與濃硫酸的反應,生成物成分的定性探究,進行如下實驗。
(1)研究小組取65.0 g鋅粒與55 mL 98%的濃硫酸(ρ=1.84 g·mL-1)充分反應,所制得的氣體成分是________(填分子式),發生反應的化學方程式為_______________________________
________________________________________________________________________。
(2)為驗證所制的氣體成分,研究小組擬定以下裝置進行實驗。
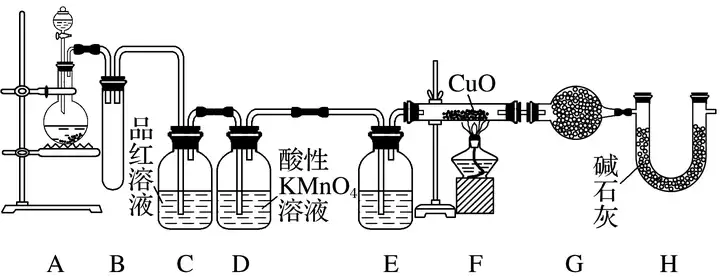
①裝置E和G中的試劑分別為________、________。
②裝置B的作用是________;H的作用是__________________________________________。
③寫出實驗中觀察到的現象及由該現象得出含有相應的氣體成分的結論。
現象
結論
答案 (1)H2和SO2 2H2SO4(濃)+Zn===ZnSO4+SO2↑+2H2O、H2SO4(稀)+Zn===ZnSO4+H2↑
(2)①濃硫酸 無水CuSO4(或無水硫酸銅)
②防止倒吸(或作安全瓶) 防止空氣中的水蒸氣進入系統,干擾實驗
③
現象
結論
C中品紅溶液褪色
氣體中有SO2
D中酸性KMnO4溶液顏色變淺,F中黑色粉末變紅,G中白色粉末變藍
氣體中有H2
解析 首先要明確實驗目的,實驗是對產生的氣體成分進行定性探究,根據鋅與濃硫酸反應生成SO2,與稀硫酸反應生成H2來分析。(1)開始時濃硫酸與鋅反應生成SO2,隨著反應的進行,濃硫酸的濃度逐漸變小,Zn與稀硫酸反應得到的氣體是H2,反應的化學方程式為2H2SO4(濃)+Zn===ZnSO4+SO2↑+2H2O,H2SO4(稀)+Zn===ZnSO4+H2↑。(2)根據SO2和H2的化學性質來選擇驗證方法,SO2能使品紅溶液褪色,H2可以還原CuO生成H2O,H2O能使白色無水CuSO4變藍色。裝置C盛放的品紅溶液用來檢驗SO2氣體,為防止裝置C發生倒吸,在A與C之間加一個防倒吸的裝置B,裝置D盛放的酸性KMnO4溶液能吸收混合氣體中的SO2,裝置E中的濃硫酸吸收水蒸氣,避免干擾后續實驗,裝置H的作用是防止空氣中的水蒸氣進入系統,干擾實驗。
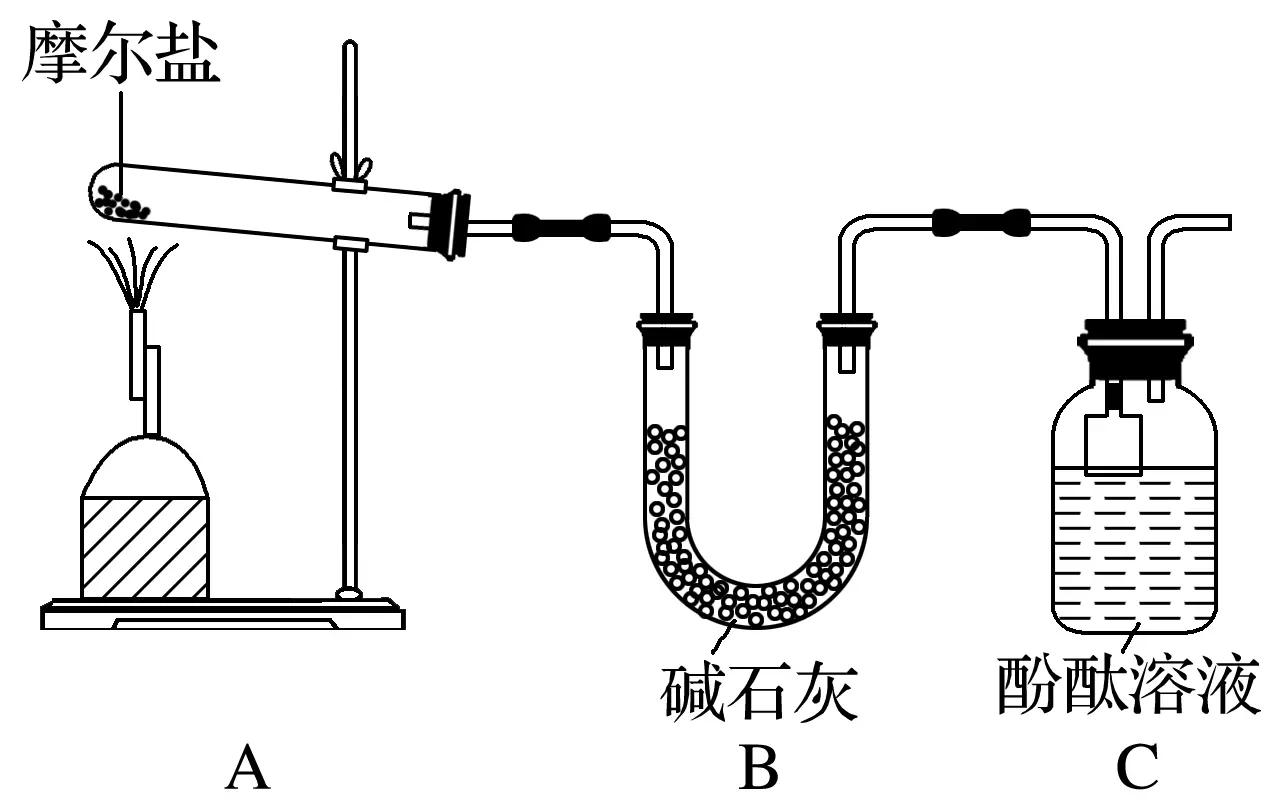
2.(2018·安徽皖南八校聯考)摩爾鹽[(NH4)2Fe(SO4)2·6H2O]在定量分析中常用作標定高錳酸鉀等溶液的標準物質,還用作化學試劑、醫藥以及用于冶金、電鍍等。回答下列問題:
(1)甲組同學按照如圖所示的裝置,通過實驗檢驗摩爾鹽晶體加強熱時的分解產物。裝置C中可觀察到的現象是____________,由此可知摩爾鹽晶體分解的產物中有________。裝置B的主要作用是_________________________________________________________________。
(2)乙組同學認為摩爾鹽晶體分解的產物中還含有SO3(g)、SO2(g)及N2。為進行驗證,選用甲組實驗中的裝置A和下圖所示的部分裝置進行實驗。
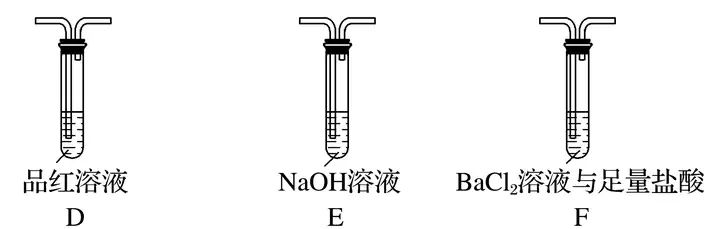
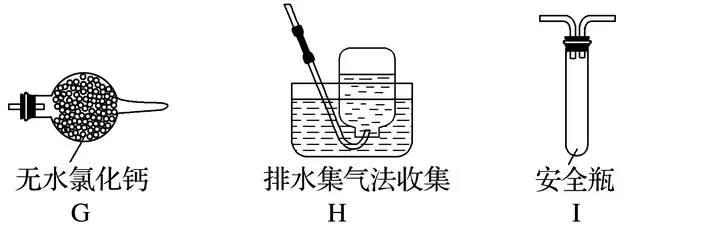
①乙組同學的實驗中,裝置依次連接的合理順序為A、____________。
②裝置F中足量鹽酸的作用是_____________________________________________________;含有SO3的實驗現象是___________________________________________________________;含有SO2的實驗現象是__________________________________________________________。
(3)設計實驗證明摩爾鹽是否已氧化變質:___________________________________________
________________________________________________________________________。
答案 (1)溶液變紅 NH3 吸收分解產生的酸性氣體
(2)①I、F、D、E、H
②吸收氨氣并將溶液酸化,排除SO2的干擾 F中有白色沉淀產生 D中品紅溶液褪色
(3)取少量晶體溶于水,滴入KSCN溶液,若溶液變紅,說明摩爾鹽已氧化變質;反之摩爾鹽未變質
解析 (1)摩爾鹽[(NH4)2Fe(SO4)2·6H2O]受熱分解,分解時會產生氨氣和二氧化硫、三氧化硫等,根據裝置圖可知,堿石灰可以吸收酸性氣體,氨氣能使酚酞溶液變紅色,所以裝置C中可觀察到的現象是溶液變紅,由此可知摩爾鹽晶體分解的產物中有NH3。裝置B的主要作用是吸收分解產生的酸性氣體。
(2)①要檢驗生成SO3(g)、SO2(g)及N2,在甲組實驗中的裝置A產生氣體后,經過安全瓶后通過氯化鋇溶液檢驗SO3,再通過品紅溶液檢驗SO2,用濃氫氧化鈉除去二氧化硫,用排水集氣法收集氮氣,所以裝置依次連接的合理順序為A、I、F、D、E、H。
②由于產生的氣體中有氨氣,所以氯化鋇溶液中加入足量的鹽酸,可以吸收氨氣并防止產生亞硫酸鋇沉淀,排除SO2的干擾,SO3通入氯化鋇溶液中可以產生硫酸鋇沉淀,二氧化硫能使品紅溶液褪色,所以裝置F中足量鹽酸的作用是吸收氨氣并將溶液酸化,排除SO2的干擾;含有SO3的實驗現象是F中有白色沉淀產生;含有SO2的實驗現象是D中品紅溶液褪色。
(3)摩爾鹽氧化變質會產生鐵離子,可以通過檢驗樣品中是否含有鐵離子判斷是否變質。
題型二 定量測定型
1.定量測定的常用方法
(1)沉淀法
先將某種成分轉化為沉淀,然后稱量純凈、干燥的沉淀的質量,再進行相關計算。
(2)測氣體體積法
對于產生氣體的反應,可以通過測定氣體體積的方法測定樣品純度。
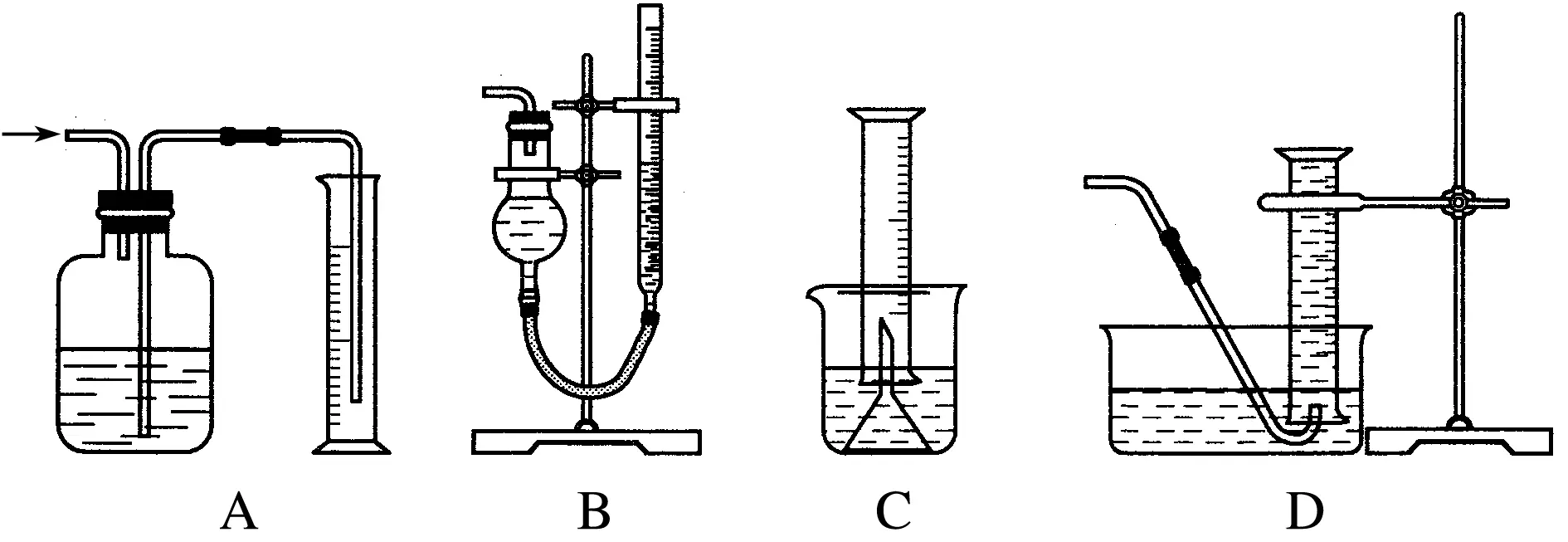
量氣裝置的設計:
下列裝置中,A是常規的量氣裝置,B、C、D是改進后的量氣裝置。
(3)測氣體質量法
將生成的氣體通入足量的吸收劑中,通過稱量實驗前后吸收劑的質量,求得所吸收氣體的質量,然后進行相關計算。
(4)滴定法
利用滴定操作原理,通過酸堿中和滴定、沉淀滴定和氧化還原滴定等獲得相應數據后再進行相關計算。
(5)熱重法
只要物質受熱時發生質量變化,都可以用熱重法來研究物質的組成。熱重法是在控制溫度的條件下,測量物質的質量與溫度關系的方法。通過分析熱重曲線,我們可以知道樣品及其可能產生的中間產物的組成、熱穩定性、熱分解情況及生成產物等與質量相聯系的信息。
2.定量測定實驗中常用的計算方法——關系式法
關系式法是表示兩種或多種物質之間“物質的量”關系的一種簡化式子。在多步反應中,它可以把始態的反應物與終態的生成物之間“物質的量”的關系表示出來,把多步計算簡化成一步完成。
正確提取關系式的關鍵:
根據化學方程式,找出作為中介的物質,并確定最初反應物、中介物質、最終生成物之間物質的量的關系。
如用Na2S2O3滴定法測水中溶氧量,經過如下三步反應,
①O2+2Mn(OH)2===2MnO(OH)2
②MnO(OH)2+2I-+4H+===Mn2++I2+3H2O
③2Na2S2O3+I2===Na2S4O6+2NaI
因此水中溶氧量與Na2S2O3之間的關系為
O2 ~ 2MnO(OH)2 ~ 2I2 ~ 4Na2S2O3
(中介物質) (中介物質)
[典例剖析] (2017·全國卷Ⅱ,28)水中的溶解氧是水生生物生存不可缺少的條件。某課外小組采用碘量法測定學校周邊河水中的溶解氧。實驗步驟及測定原理如下:
Ⅰ.取樣、氧的固定
用溶解氧瓶采集水樣。記錄大氣壓及水體溫度。將水樣與Mn(OH)2堿性懸濁液(含有KI)混合,反應生成MnO(OH)2,實現氧的固定。
Ⅱ.酸化、滴定
將固氧后的水樣酸化,MnO(OH)2被I-還原為Mn2+,在暗處靜置5 min,然后用標準Na2S2O3溶液滴定生成的I2(2S2O+I2===2I-+ S4O)。
回答下列問題:
(1)取水樣時應盡量避免攪動水體表面,這樣操作的主要目的是______________________。
(2)“氧的固定”中發生反應的化學方程式為______________________________________。
(3)Na2S2O3溶液不穩定,使用前需標定。配制該溶液時需要的玻璃儀器有燒杯、玻璃棒、試劑瓶和________;蒸餾水必須經過煮沸、冷卻后才能使用,其目的是殺菌、除________及二氧化碳。
(4)取100.00 mL水樣經固氧、酸化后,用amol·L-1Na2S2O3溶液滴定,以淀粉溶液作指示劑,終點現象為____________________________________________________________________;若消耗Na2S2O3溶液的體積為bmL,則水樣中溶解氧的含量為________ mg·L-1。
(5)上述滴定完成時,若滴定管尖嘴處留有氣泡會導致測定結果偏________。(填“高”或“低”)
[思路引導]
第(1)問考查化學實驗基本操作,取樣的代表性,攪動會影響正常水樣中的氧氣的溶解度(排干擾)。
第(2)問考查陌生方程式的書寫,理解“氧的固定”方法。
第(3)問考查化學實驗基本操作以及提取信息的能力。由于“Na2S2O3不穩定”,無需精確配制,氧氣能氧化Na2S2O3,會干擾測定結果。
第(4)問考查滴定終點的判斷以及關系式法計算。
第(5)問考查誤差分析,關鍵是找到含氧量與讀取Na2S2O3體積的關系。
解析 本題采用碘量法測定水中的溶解氧的含量,屬于氧化還原滴定。
(2)根據氧化還原反應原理,Mn(OH)2被氧氣氧化為MnO(OH)2,由此可得方程式2Mn(OH)2+O2===2MnO(OH)2。
(3)一定物質的量濃度溶液的配制還需要量筒;加熱可以除去溶解的氧氣,避免實驗結果不準確。
(4)該實驗用硫代硫酸鈉標準液滴定I2,因此終點現象為當最后一滴標準液滴入時,溶液由藍色變為無色,且半分鐘內無變化;
根據關系式O2~2MnO(OH)2~2I2~4Na2S2O3
可得水樣中溶解氧的含量為[(ab×10-3) mol÷4×32 g·mol-1×103 mg·g-1]÷0.1 L=80abmg·L-1。
(5)終點讀數時有氣泡,氣泡占據液體應占有的體積,會導致測得的消耗的Na2S2O3體積偏小,最終結果偏低。
答案 (1)使測定值與水體中的實際值保持一致,避免產生誤差 (2)2Mn(OH)2+O2===2MnO(OH)2 (3)量筒 氧氣 (4)當最后一滴標準液滴入時,溶液由藍色變為無色,且半分鐘內無變化 80ab (5)低

1.碳、硫的含量影響鋼鐵性能。碳、硫含量的一種測定方法是將鋼樣中碳、硫轉化為氣體,再用測碳、測硫裝置進行測定。
(1)采用裝置A,在高溫下將x克鋼樣中碳、硫轉化為CO2、SO2。
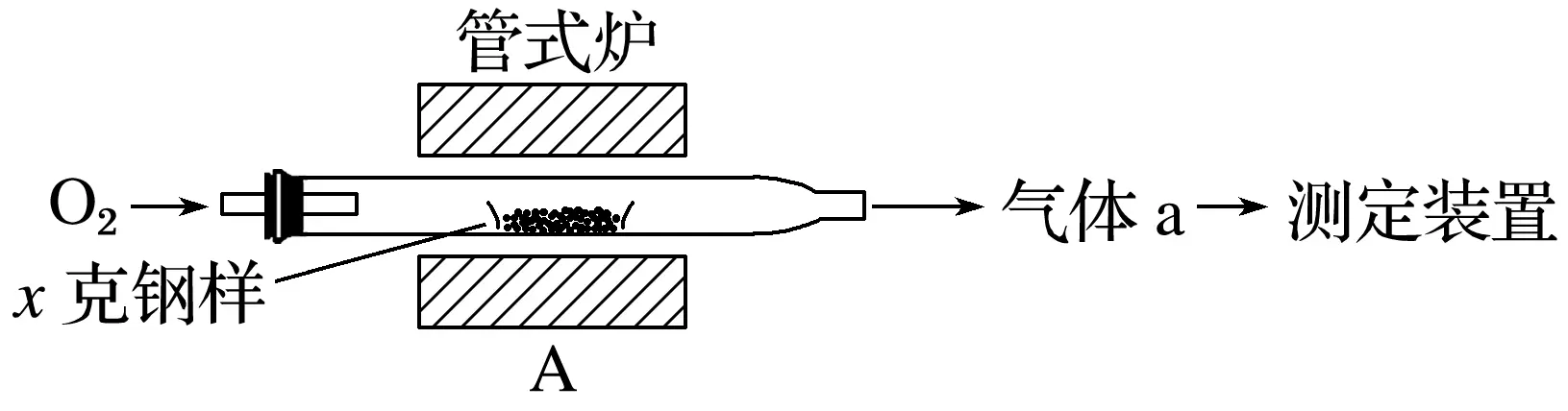
①氣體a的成分是________。
②若鋼樣中硫以FeS的形式存在,A中反應:3FeS+5O21________+3________。
(2)將氣體a通入測硫裝置中(如下圖),采用滴定法測定硫的含量。
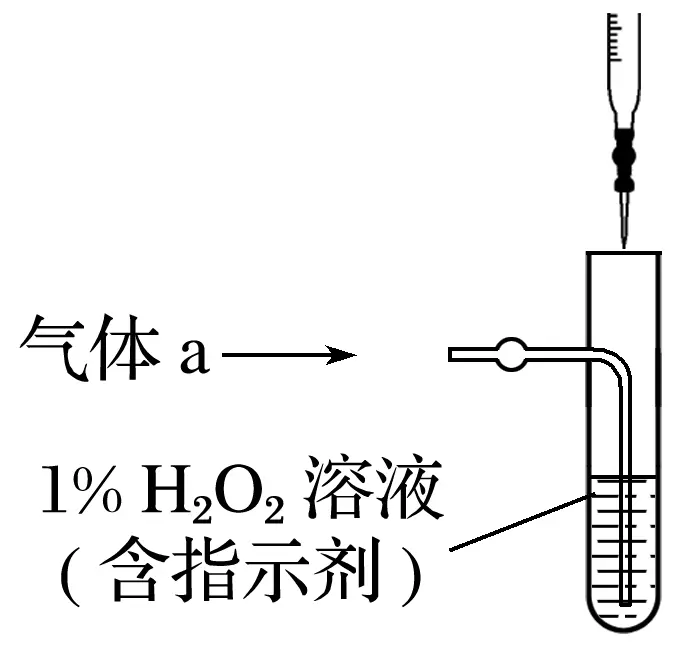
①H2O2氧化SO2的化學方程式:_________________________________________________
________________________________________________________________________。
②用NaOH溶液滴定生成的H2SO4,消耗zmL NaOH溶液,若消耗1 mL NaOH溶液相當于硫的質量為y克,則該鋼樣中硫的質量分數:________。
(3)將氣體a通入測碳裝置中(如下圖),采用重量法測定碳的含量。
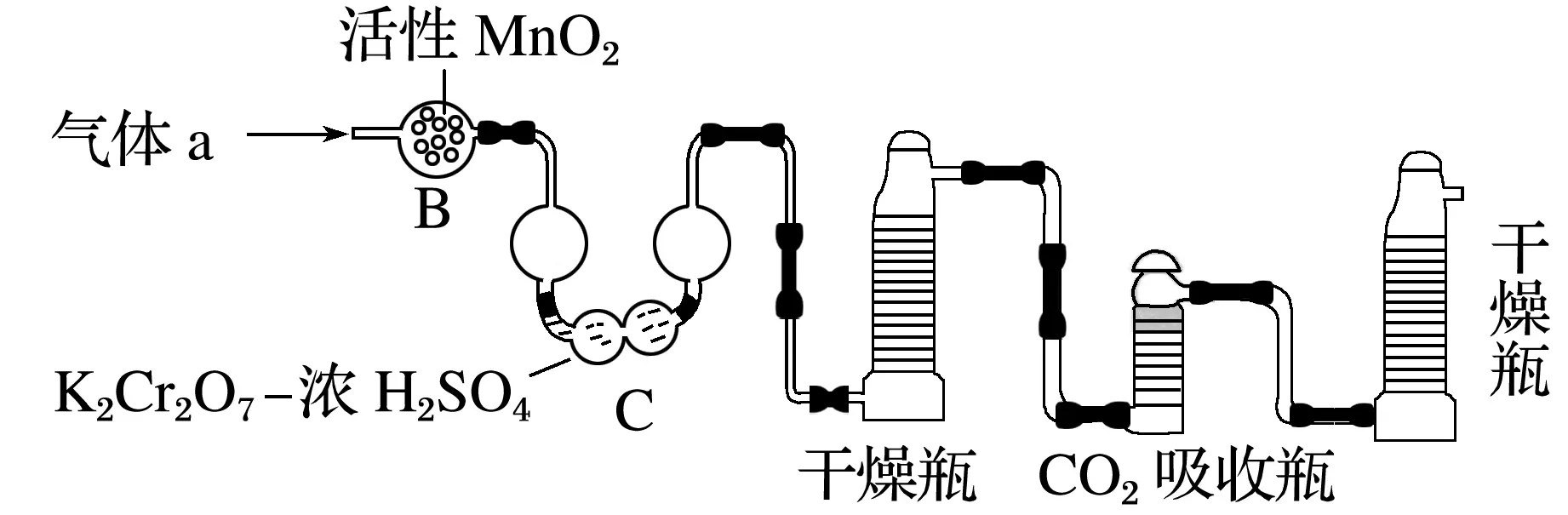
①氣體a通過B和C的目的是___________________________________________________。
②計算鋼樣中碳的質量分數,應測量的數據是_________________________________________
________________________________________________________________________。
答案 (1)①O2、SO2、CO2 ②Fe3O4 SO2
(2)①H2O2+SO2===H2SO4 ②
(3)①排除SO2對CO2測定的干擾 ②吸收CO2前、后吸收瓶的質量
解析 (1)①鋼樣中的碳、硫在裝置A中高溫加熱條件下生成CO2和SO2,還有未反應的O2,故氣體a的成分為O2、SO2、CO2。②根據得失電子守恒和質量守恒定律配平化學方程式:3FeS+5O2Fe3O4+3SO2。(2)①H2O2和SO2發生氧化還原反應:H2O2+SO2===H2SO4。②根據題意,消耗1 mL NaOH溶液相當于硫的質量為y克,則消耗zmL NaOH溶液,相當于硫的質量為yzg,所以鋼樣中硫的質量分數為或×100%。(3)①氣體a中含有O2、SO2和CO2,在吸收CO2測定碳的含量時,也可能吸收SO2,故氣體a通過裝置B和C的目的是排除SO2對CO2測定的干擾。②計算鋼樣中碳的質量分數,應測量吸收CO2前、后吸收瓶的質量,其質量差為CO2的質量。
2.(2018·重慶合川區適應性測試)某助熔劑具有較好的熱穩定性,是兩種常見鈉鹽的混合物,其中一種組分是NaCl。為確定另一種組分X及其含量,甲、乙兩個小組進行了以下實驗。
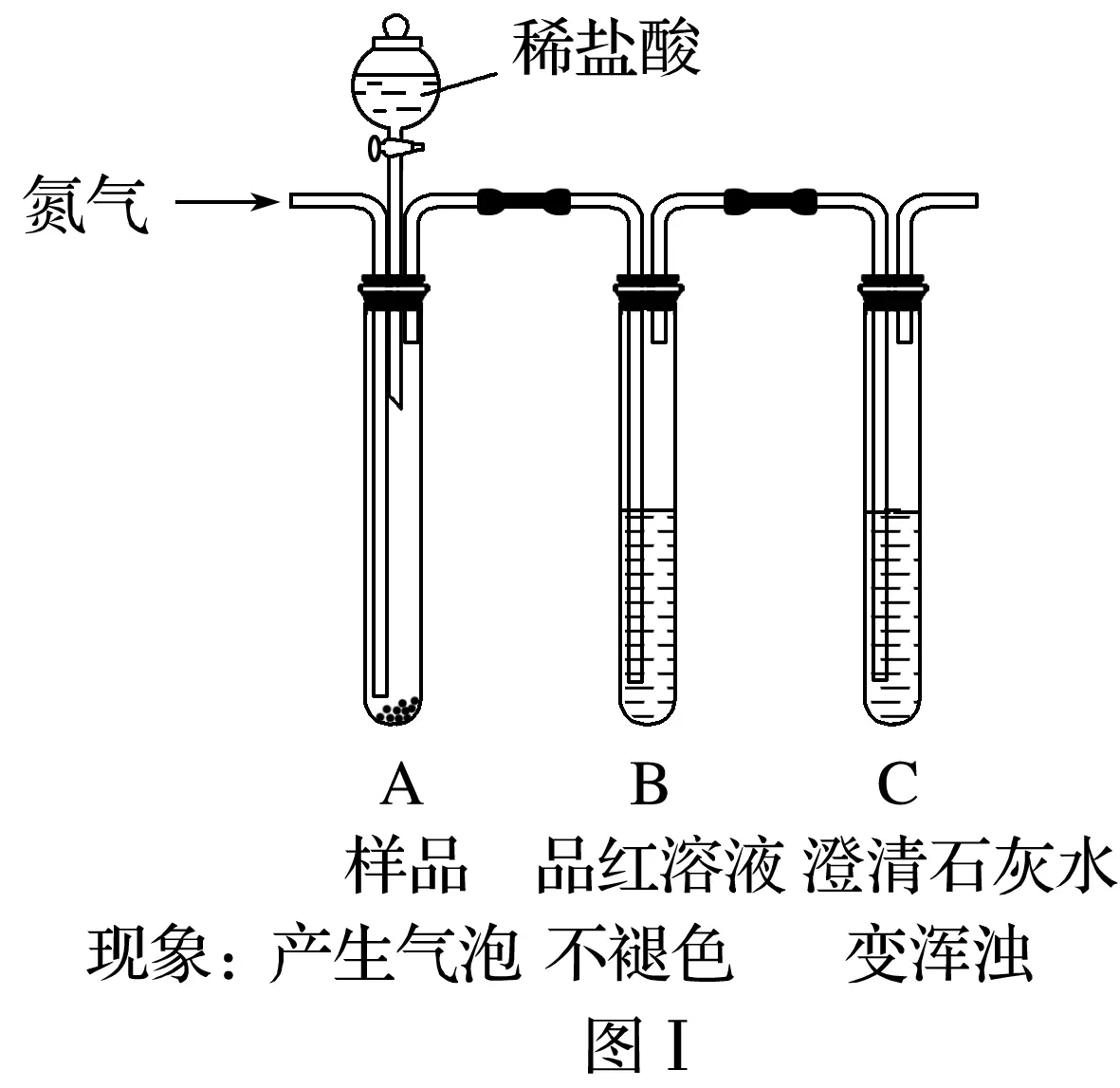
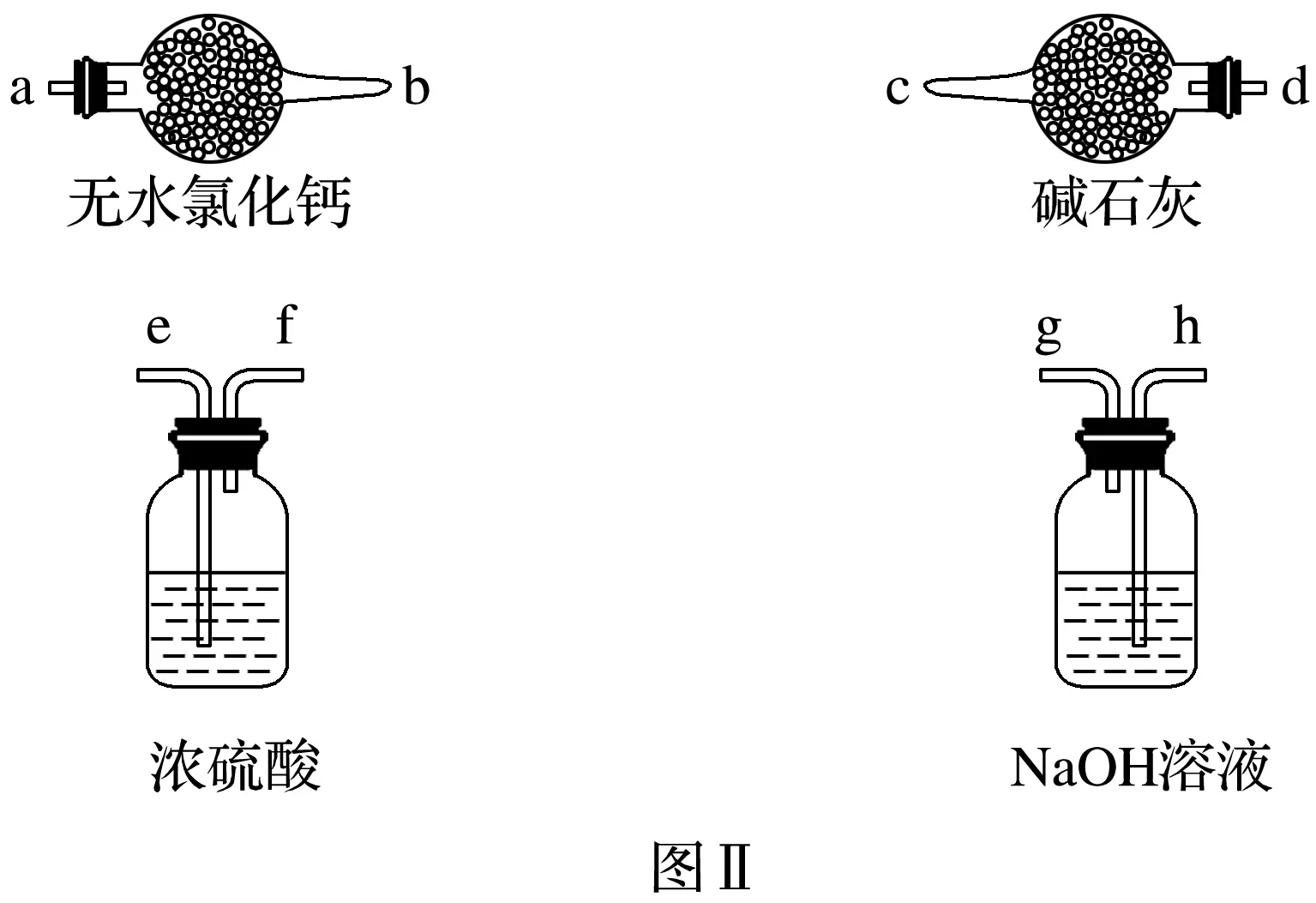
(1)取適量樣品,注入裝置A中,測定組分X的化學式。
①甲組用圖Ⅰ的裝置進行實驗,觀察到相應實驗現象,則X的化學式是________。
②乙組只用圖 Ⅰ 中裝置A和C進行實驗,得到與甲組相同的實驗結論,則分液漏斗中盛放的溶液應換為______,原因是__________________________________________________
________________________________________________________________________。
(2)甲、乙組分別用以下方法測定組分X的含量。
①甲組用裝置A和圖Ⅱ中所示的部分裝置(可重復選用)進行實驗。請選擇必要的裝置,依次連接的合理順序為裝置A后接________(填儀器接口的字母)。完成一組實驗,除樣品的質量外,還需測定的實驗數據有_______________________________________________________
________________________________________________________________________。
②乙組用酸堿滴定法測定X的含量。準確稱取兩份樣品,滴入少量水潤濕后,分別加入0.200 0 mol·L-1的鹽酸40.00 mL,加入2滴酚酞作為指示劑,用0.200 0 mol·L-1的NaOH溶液滴定過量鹽酸至終點,實驗數據列于下表中。
m試樣/g
V(NaOH)/mL
滴定前刻度
滴定后刻度
0.320 0
0.52
20.48
0.320 0
0.35
20.39
回答下列問題:
Ⅰ.滴定過程中選用的滴定管是____________。
Ⅱ.滴定至終點時的現象為________________________________________________________
________________________________________________________________________。
Ⅲ.樣品中X的質量分數為________。
③乙組測得的X含量比實際值偏高,可能的原因是________(填字母)。
A.用NaOH溶液潤洗滴定管
B.滴定終點讀數時仰視液面刻度
C.用樣品溶液潤洗錐形瓶
D.滴定終點時滴定管尖嘴部分出現氣泡
答案 (1)①Na2CO3 ②稀硝酸 Na2CO3和Na2SO3分別與稀硝酸反應裝置C中的實驗現象不同
(2)①e,f,d,c,h(其他合理答案也可) 盛裝堿石灰的干燥管實驗前后的質量 ②Ⅰ.堿式滴定管 Ⅱ.最后一滴標準液滴下,溶液由無色變成紅色,且30秒內不褪色 Ⅲ.66.25% ③CD
解析 (1)①與鹽酸反應得到的氣體不能使品紅溶液褪色,而能使澄清石灰水變渾濁,說明生成的氣體為CO2,則該助熔劑中含有Na2CO3或NaHCO3,由于NaHCO3受熱易分解,熱穩定性較差,所以X是Na2CO3。②乙組只用裝置A和C即可得到相同的實驗結論,說明反應過程中只有CO2生成,則分液漏斗中應盛裝稀硝酸,以排除亞硫酸鈉的影響。(2)①測定原理應為向樣品中加入足量稀鹽酸,使Na2CO3完全反應生成CO2,干燥后用堿石灰吸收,稱量盛堿石灰的干燥管實驗前后的質量,二者之差即為生成的CO2的質量。②NaOH溶液應盛在堿式滴定管中,到達滴定終點時,溶液由無色變成紅色,且30秒內不褪色。兩次滴定消耗NaOH溶液的體積的平均值為20.00 mL,則樣品消耗鹽酸n(HCl)=0.200 0 mol·L-1×0.040 00 L-0.200 0 mol·L-1×0.020 00 L=0.004 mol,n(Na2CO3)=n(HCl)=0.002 mol,則樣品中Na2CO3的質量分數為×100%=66.25%。③滴定時,滴定管必須用標準溶液潤洗,不會造成誤差,A項不符合題意;滴定終點讀數時仰視液面刻度,使所讀數值偏大,則結果會偏小,B項不符合題意;用樣品溶液潤洗錐形瓶,會使樣品消耗的鹽酸體積偏大,則結果偏大,C項符合題意;滴定終點時滴定管尖嘴部分出現氣泡,會造成HCl所消耗的NaOH溶液的體積偏小,則樣品消耗的鹽酸的體積偏大,最終結果偏大,D項符合題意。
歡迎使用手機、平板等移動設備訪問中考網,2025中考一路陪伴同行!>>點擊查看