來源:網絡資源 2023-01-08 20:41:33
溶解度表是中學化學溶液部分的重要知識點,讀懂溶解度表對化學的學習是非常重要的。除了讀懂,還要能記憶,并用在解題中熟練運用,而這些都必須建立在理解的基礎上。
溶解度表分成三個部分,第一行是陰離子,即氫氧根離子和酸根離子,常用的酸根有硝酸根、氯根也就是氯離子、硫酸根離子和碳酸根離子;第一列是陽離子,包括氫離子、銨根離子和各類金屬離子,有鉀、鈉、鋇、鈣、鎂、鋁、錳、鋅、亞鐵、鐵、銅和銀離子;主體部分是各類陰離子和陽離子結合形成的化合物的溶解度情況。
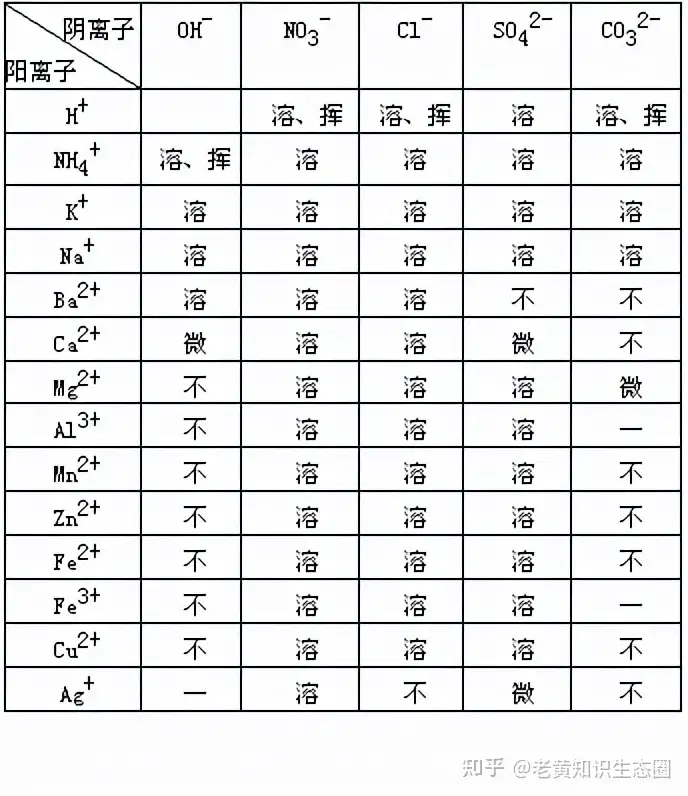
其中溶解度小于0.01g的稱為難溶,記作“不”;溶解度在0.01-1g之間的是微溶,記為“微”;溶解度在1-10g的稱為可溶,溶解度大于10g的,稱為易溶,都記為“溶”。除此之外,在一般的條件下,陰離子和陽離子無法形成化合物的,用“-”表示;物理性質和化學性質不穩定,容易產生氣體逃逸的,記為“揮”,即具有揮發性。其中只有鹽酸是以氯化氫氣體的形式揮發,化學性質不變,屬于物理變化。而氫氧化銨、硝酸、碳酸揮發時,都會生成新的氣體,屬于化學變化。
觀察溶解度表,可以發現,所有硝酸鹽都是可溶或易溶的;銨鹽也都是易溶的;活潑性最強的鉀、鈉金屬離子形成的銀也都是易溶的。氯根只有銀鹽,即氯化銀不可溶,因此關于氯根的復分解反應,經常有銀離子參與,生成氯化銀沉淀。硫酸根也只有鋇鹽,即硫酸鋇不可溶,因此關于硫酸根的復分解反應,也常有鋇離子參與,生成硫酸鋇。另外硫酸鈣和硫酸銀都微溶,其中前者常被用來問“為什么不用硫酸制二氧化碳”,后者在考試中出現的概率不高。
主要的不溶物集中在堿和碳酸鹽,其中從鎂離子以后,比活潑性不如鎂的金屬離子形成的堿,基本上都不可溶,其中銀離子在一般地條件下,還不能和氫氧根結合。這些不溶性的堿還有一個重要的知識點,就是它們形成的沉淀有一個顏色的問題。氫氧化銅是藍色的,氫氧化鐵紅棕色的,氫氧化亞鐵是白色的等,需要平時多觀察,積累。氫氧化鈣比較特殊,是一種微溶物,所以我們可以得到澄清的石灰水。
碳酸鹽從鋇鹽開始,只有碳酸鎂可溶,以及一般條件下,不能和鋁離子以及鐵離子結合,其它活動性不如鈉的金屬鹽,都是不溶于水的深淀。
歡迎使用手機、平板等移動設備訪問中考網,2025中考一路陪伴同行!>>點擊查看