來源:網絡資源 2023-07-06 21:36:23
一. 物質溶解過程中的能量變化
物質溶解過程的微觀解釋,在物質溶解的過程中,實際存在兩個過程:
1. 溶質的分子或離子向水溶液擴散的過程吸收熱量;
2. 溶質的分子或離子與水作用的過程放出熱量。
當吸收的熱量大于放出的熱量時,溶解過程吸熱,當吸收的熱量小于放出的熱量時放出熱量。
物質溶解過程吸熱還是放熱取決于物質本身的性質,我們可以利用這一性質來鑒別物質。
綜上,物質溶解過程中溫度的變化情況有三種:
1. 升高:氫氧化鈉
2. 不變:氯化鈉
3. 降低:硝酸鉀
以上例子來自于滬教版課本活動與探究,同學們在做題的時候也可把自己遇到的補充完整,豐富自己的知識體系,養成歸納和總結的好習慣。
知識點辨析:
物質的溶解度隨溫度的變化情況
在溶液這一章,我們還會學習到一個知識點“”,大家一定要注意這是兩個不同的概念。比如硝酸銨它的溶解度隨溫度的升高而升高,但是在溶解的過程中,還是會吸收熱量,使溶液的溫度降低,而氫氧化鈣在溶解的過程中釋放熱量,但是它的溶解度隨溫度的升高而降低。
二. 溶液的導電性
有些溶液可以導電,有些溶液不能夠導電,這主要取決于什么呢?我們可以做一個簡單的實驗。
實驗步驟:
在5個燒杯中分別加入一定量的水、食鹽溶液、蔗糖溶液、稀硫酸和稀氫氧化鈉溶液,分別按照下圖裝置進行實驗。當閉合開關時。觀察實驗現象。
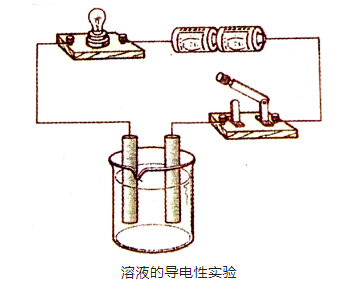
實驗現象:
1. 裝有食鹽溶液、稀硫酸溶液和稀氫氧化鈉溶液的燒杯閉合開關時,燈泡發光;
2. 裝有水和蔗糖溶液的燒杯閉合開關時,燈泡不發光。
實驗結論:
水的導電性非常微弱,而在水中加入食鹽、硫酸和氫氧化鈉等物質后形成溶液,導電性明顯增強。研究表明:這些物質在水中溶解時能生成自由移動的離子,使得溶液能夠導電。例如,食鹽溶于水生成自由移動的鈉離子和氯離子,氫氧化鈉溶液水生成自由移動的鈉離子和氫氧根離子,稀硫酸中含有自由移動的氫離子和硫酸根離子,所以食鹽水、氫氧化鈉和稀硫酸都能夠導電。
蔗糖溶于水后,蔗糖以分子的形式存在于水中,不能形成自由移動的離子,因此蔗糖水溶液很難導電。
知識點補充:
1. 在“電解水的實驗”中,在水里面加入少量硫酸鈉或氫氧化鈉溶液,就是為了增強水的導電性。
2. 能夠導電的物質
I. 金屬——常用來做導線
II. 石墨——電池電極
III.溶液——某些物質在水中溶解時能生成自由移動的離子的溶液可以導電
三. 稀溶液的沸騰溫度
大量實驗表明,少量的固體物質溶于水,使稀溶液的沸騰溫度升高(高于100℃)
這也就可以解釋生活中:煮沸的湯或粥比煮沸的水的溫度要高。
四.稀溶液的凝固溫度
少量的固體物質溶于水后,稀溶液的凝固溫度降低(低于0℃),這一性質在生活中廣泛應用:
1. 冬天常在汽車的水箱中加入少量乙二醇之類的化合物以防止水箱中的水結冰;
2. 寒冷的冬天,在積雪的公路上撒鹽,可以使冰雪很快融化;
3. 冷卻劑,某些物質和冰混合可以提供比0℃更低的溫度。
編輯推薦:

歡迎使用手機、平板等移動設備訪問中考網,2025中考一路陪伴同行!>>點擊查看