來源:網絡資源 2023-08-28 18:12:36
酸及酸的化學性質
酸在水溶液中能解離出氫離子(H+)和酸根離子。常見的酸有①鹽酸(HCl)②硫酸(H₂SO4) ③硝酸(HNO₃)④醋酸(CH₃COOH)
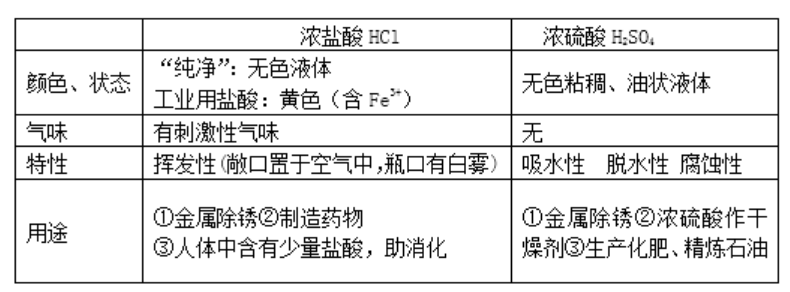
1.濃鹽酸、濃硫酸的特性、用途
2.酸的化學性質
①紫色石蕊試液遇酸變紅,無色酚酞試液遇酸不變色。
②活潑金屬+酸→鹽+氫氣(注:此處酸不包括濃硫酸和硝酸)
Zn+H₂SO4=ZnSO4+H₂↑ Zn+2HCl=ZnCl2+H₂↑
Fe+H₂SO4=FeSO4+H₂↑ Fe+2HCl=FeCl2+H₂↑
2Al+3H₂SO4=Al₂(SO4)₃+3H₂↑
2Al+6HCl=2AlCl₃+3H₂↑
③金屬氧化物+酸→鹽+水
Fe₂O₃+6HCl=2FeCl₃+3H₂O
Fe₂O₃+3H₂SO4=Fe2(SO4)₃+3H₂O
CuO+H₂SO4=CuSO4+H₂O
CuO+2HCl=CuCl2+H₂O
④堿+酸→鹽+水
NaOH+HCl=NaCl+H₂O
Ca(OH)₂+H₂SO4=CaSO4+2H₂O
3HCl + Al(OH)₃ = AlCl₃ + 3H₂O
⑤*鹽+酸→新鹽+新酸
AgNO₃+HCl=AgCl↓+HNO₃
BaCl₂+H₂SO4=BaSO4↓+2HCl
編輯推薦:

歡迎使用手機、平板等移動設備訪問中考網,2025中考一路陪伴同行!>>點擊查看